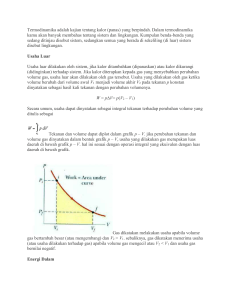
Makalah Sistem Termodinamika
advertisement

KATA PENGANTAR Puji dan syukur kami panjatkan kehadirat Allah SWT atas segala limpahan rahmat dan hidayah-Nya sehingga kami dapat menyelesaikan penyusunan makalah ini. Kami telah menyusun makalah ini dengan sebaik-baiknya dan semaksimal mungkin. Namun tentunya sebagai manusia biasa tidak akan luput dari kesalahan dan kekurangan. Harapan kami, semoga bisa menjadi koreksi di masa mendatang agar lebih baik dari sebelumnya. Pada dasarnya makalah ini kami sajikan untuk membahas tentang “SISTEM TERMODINAMIKA”. Untuk lebih jelas simak pembahasan dalam makalah ini. Mudah-mudahan makalah ini bisa memberikan pengetahuan yang mendalam tentang termodinamika kepada kita semua. Makalah ini masih banyak memiliki kekurangan. Tak ada gading yang tak retak. Oleh karena itu, kami mengharapkan kritik dan saran dari teman-teman untuk memperbaiki makalah kami selanjutnya. Sebelum dan sesudahnya kami ucapkan terimakasih. Medan, 10 Oktober 2016 Penyusun 1 DAFTAR ISI HALAMAN JUDUL KATA PENGANTAR …………………………………………………… 2 DAFTAR ISI …………………………………………………… 3 BAB I PENDAHULUAN ………………………………………………….... 4 1.1 Latar Belakang ………….………………………………………... 4 1.2 Rumusan Masalah …………………………………………………... 4 1.3 Tujuan …………………………………………………... 4 1.4 Manfaat …………………………………………………... 4 BAB II PEMBAHASAN 2.1 Pengertian Termodinamika …………………………………………………... 5 2.2 Bentuk-Bentuk Energi 2.3 2.4 …………………………………………………... 6 Sistem, Proses & Siklus Termo………………………………………………….. 7 Hukum Termodinamika ………………………………………………….. 8 2.4.1 Termodinamika I ………………………………………………….. 9 2.4.2 Termodinamika II …………………………………………………... 12 2.4.3 Termodinamika III …………………………………………………... 14 BAB III PENUTUP Kesimpulan ………………………………………………….. 16 Saran ………………………………………………….. 16 DAFTAR PUSTAKA ………………………………………………...... 17 2 BAB I PENDAHULUAN 1.1 Latar Belakang Thermodinamika memainkan peran penting dalam analisis sistem dan piranti yang ada didalamnya terjadi perpindahan formasi energi. Implikasi thermodinamika bercakupan jauh, dan penerapannya membentang ke seluruh kegiatan manusia. Bersamaan dengan sejarah teknologi kita, perkembangan sains telah memperkaya kemampuan kita untuk memanfaatkan energi dan menggunakan energi tersebut untuk kebutuhan masyarakat. Kebanyakan kegiatan kita melibatkan perpindahan energi dan perubahan energi. Thermodinamika merupakan ilmu tentang energi, yang secara spesific membahas tentang hubungan antara energi panas dengan kerja. Seperti telah diketahui bahwa energi didalam alam dapat terwujud dalam berbagai bentuk, selain energi panas dan kerja, yaitu energi kimia, energi listrik, energi nuklir, energi gelombang elektromagnit, energi akibat gaya magnit, dan lain-lain . Energi dapat berubah dari satu bentuk ke bentuk lain, baik secara alami maupun hasil rekayasa tehnologi. Selain itu energi di alam semesta bersifat kekal, tidak dapat dibangkitkan atau dihilangkan, yang terjadi adalah perubahan energi dari satu bentuk menjadi bentuk lain tanpa ada pengurangan atau penambahan. Prinsip ini disebut sebagai prinsip konservasi atau kekekalan energi. 1.2 Rumusan Masalah Adapun masalah yang akan dibahas pada makalah ini yaitu: Apa pengertian dari hukum-hukum Termodinamika? 1.3 Tujuan Adapun tujuan penulisan Makalah ini yaitu: Dapat memahami bentuk-bentuk energi thermodinamika Dapat mengetahui hukum-hukum dari Thermodinamika 1.4 Manfaat Makalah ini dapat memberikan beberapa manfaat, diantarnya dapat menambah wawasan dan pengetahuan bagi pembaca. 3 BAB II PEMBAHASAN 2.1 Pengertian Dasar Thermodinamika Thermodinamika adalah ilmu tentang energi, yang secara spesific membahas tentang hubungan antara energi panas dengan kerja. Seperti telah diketahui bahwa energi didalam alam dapat terwujud dalam berbagai bentuk, selain energi panas dan kerja, yaitu energi kimia, energi listrik, energi nuklir, energi gelombang elektromagnit, energi akibat gaya magnit, dan lain-lain . Energi dapat berubah dari satu bentuk ke bentuk lain, baik secara alami maupun hasil rekayasa tehnologi. Selain itu energi di alam semesta bersifat kekal, tidak dapat dibangkitkan atau dihilangkan, yang terjadi adalah perubahan energi dari satu bentuk menjadi bentuk lain tanpa ada pengurangan atau penambahan. Prinsip ini disebut sebagai prinsip konservasi atau kekekalan energi. Prinsip thermodinamika tersebut sebenarnya telah terjadi secara alami dalam kehidupan sehari-hari. Bumi setiap hari menerima energi gelombang elektromagnetik dari matahari, dan di bumi energi tersebut berubah menjadi energi panas, energi angin, gelombang laut, proses pertumbuhan berbagai tumbuh-tumbuhan dan banyak proses alam lainnya. Proses didalam diri manusia juga merupakan proses konversi energi yang kompleks, dari input energi kimia dalam makanan menjadi energi gerak berupa segala kegiatan fisik manusia, dan energi yang sangat bernilai yaitu energi pikiran kita. Dengan berkembangnya ilmu pengetahuan dan teknologi, maka prinsip alamiah dalam berbagai proses thermodinamika direkayasa menjadi berbagai bentuk mekanisme untuk membantu manusia dalam menjalankan kegiatannya. Mesin-mesin transportasi darat, laut, maupun udara merupakan contoh yang sangat kita kenal dari mesin konversi energi, yang merubah energi kimia dalam bahan bakar atau sumber. energi lain menjadi energi mekanis dalam bentuk gerak atau perpindahan diatas permukaan bumi, bahkan sampai di luar angkasa. Pabrik-pabrik dapat memproduksi berbagai jenis barang, digerakkan oleh mesin pembangkit energi listrik yang menggunakan prinsip konversi energi panas dan kerja. Untuk kenyamanan hidup, kita memanfaatkan mesin air conditioning, mesin pemanas, dan refrigerators yang menggunakan prinsip dasar thermodinamila. Aplikasi thermodinamika yang begitu luas dimungkinkan karena perkembangan ilmu thermodinamika sejak abad 17 yang dipelopori 4 dengan penemuan mesin uap di Inggris, dan diikuti oleh para ilmuwan thermodinamika seperti Willian Rankine, Rudolph Clausius, dan Lord Kelvin pada abad ke 19. Pengembangan ilmu thermodinamika dimulai dengan pendekatan makroskopik, yaitu sifat thermodinamis didekati dari perilaku umum partikel-partikel zat yang menjadi media pembawa energi, yang disebut pendekatan thermodinamika klasik. Pendekatan tentang sifat thermodinamis suatu zat berdasarkan perilaku kumpulan partikel-partikel disebut pendekatan mikroskopis yang merupakan perkembangan ilmu thermodinamika modern, atau disebut thermodinamika statistik. Pendekatan thermodinamika statistik dimungkinkan karena perkembangan teknologi komputer, yang sangat membantu dalam menganalisis data dalam jumlah yang sangat besar. 2.2 Bentuk-Bentuk Energi Total energi (E) suatu sistem merupakan jumlah dari energi thermal, mekanis, kinetis, potensial, elektrik, magnetik, kimia dan nuklir. Di dalam thermodinamika yang dipelajari adalah besarnya perubahan dari satu bentuk energi ke bentuk lainnya, bukan menghitung jumlah anergi dari suatu sistem. Bentuk energi dibagi menjadi dua kelompok: 1. Energi Makroskopik: Berhubungan dengan gerak dan pengaruh luar seperti gravitasi, magnetik, elektrik dan tegangan permukaan. Energi Makroskopik terdiri dari: Energi Kinetik ( KE ): Energi yang disebabkan oleh gerakan relatif terhadap suatu referensi. Adapun besarnya dalam berntuk energi per-satuan masa dengan: * m= satuan masa media pembawa energi * v= satuan kecepatan gerakan masa Energi Potensial ( PE ): Energi yang disebabkan oleh elevasinya dalam medan gravitasi, besarnya adalah: PE= m.g.z 5 2. Energi Mikroskopik: Berhubungan dengan struktur molekul dan derajat aktivitas molekul. Jumlah total energi mikroskopik disebut energi dalam (internal energy) , dengan simbol U. Energi Mikroskopik terdiri dari: Energi Sensibel : Berhubungan dengan energi kinetik dan gerakan (translasi, rotasi, vibrasi) molekul sistem. Energi Latent : Berhubungan dengan fasa dari sistem, mencair, menguap dll. Energi Kimia : Berhubungan dengan ikatan atm-atom dalam sistem. Dengan demikian energi total suatu sistem hanya dipengaruhi oleh energi kinetik,energi potensial dan energi dalam. 2.3 SISTEM, PROSES DAN SIKLUS TERMODINAMIKA Suatu sistem thermodinamika adalah sustu masa atau daerah yang dipilih, untuk dijadikan obyek analisis. Daerah sekitar sistem tersebut disebut sebagai lingkungan. Batas antara sistem dengan lingkungannya disebut batas sistem (boundary), dalam aplikasinya batas sistem merupakan bagian dari sistem maupun lingkungannya, dan dapat tetap atau dapat berubah posisi atau bergerak. Dalam thermodinamika ada dua jenis sistem, yaitu sistem tertutup dan sistem terbuka. Dalam sistem tertutup masa dari sistem yang dianalisis tetap dan tidak ada masa keluar dari sistem atau masuk kedalam sistem,tetapi volumenya bisa berubah. Yang dapat-keluar masuk sistem tertutup adalah energi dalam bentuk panas atau kerja. Contoh sistem tertutup adalah suatu balon udara yang dipanaskan, dimana masa udara didalam balon tetap, tetapi volumenya berubah, dan energi panas masuk kedalam masa udara didalam balon. Dalam sistem terbuka, energi dan masa dapat keluar sistem atau masuk kedalam sistem melewati batas sistem. Sebagian besar mesin-mesin konversi energi adalah sistem terbuka. Sistem mesin motor bakar adalah ruang didalam silinder mesin, dimana campuran bahan bahan bakar dan udara masuk kedalam silinder, dan gas buang keluar sistem. melalui knalpot. 6 Turbin gas, turbin uap, pesawat jet dan lain-lain adalah merupakan sistem thermodinamika terbuka, karena secara simultan ada energi dan masa keluar-masuk sistem tersebut. Karakteristik yang menentukan sifat dari sistem disebut property dari sistem, seperti tekanan P, temperatur T, volume V, masa m, viskositas, konduksi panas, dan lain-lain. Selain itu ada juga property yang disefinisikan dari property yang lainnya seperti, berat jenis, volume spesifik, panas jenis, dan lain-lain. Suatu sistem dapat berada pada suatu kondisi yang tidak berubah, apabila masing-masing jenis property sistem tersebut dapat diukur pada semua bagiannya dan tidak berbeda nilainya. Kondisi tersebut disebut sebagai keadaan (state) tertentu dari sistem, dimana sistem mempunyai nilai property yang tetap. Apabila property nya berubah, maka keadaan sistem tersebut disebut mengalami perubahan keadaan. Suatu sistem yang tidak mengalami perubahan keadaan disebut sistem dalam keadaan seimbnag (equilibrium). Perubahan sistem thermodinamika dari keadaan seimbang satu menjadi keadaan seimbang lain disebut proses, dan rangkaian keadaan diantara keadaan awal dan akhir disebut lintasan proses. Suatu sistem disebut menjalani suatu siklus, apabila sistem tersebut menjalani rangkaian beberapa proses, dengan keadaan akhir sistem kembali ke keadaan awalnya. 2.4 HUKUM-HUKUM TERMODINAMIKA Energi Dalam Suatu gas yang berada dalam suhu tertentu dikatakan memiliki energi dalam. Energi dalam gas berkaitan dengan suhu gas tersebut dan merupakan sifat mikroskopik gas tersebut. Meskipun gas tidak melakukan atau menerima usaha, gas tersebut dapat memiliki energi yang tidak tampak tetapi terkandung dalam gas tersebut yang hanya dapat ditinjau secara mikroskopik. Berdasarkan teori kinetik gas, gas terdiri atas partikel-partikel yang berada dalam keadaan gerak yang acak. Gerakan partikel ini disebabkan energi kinetik rata-rata dari seluruh partikel yang bergerak. Energi kinetik ini berkaitan dengan suhu mutlak gas. Jadi, energi dalam dapat ditinjau sebagai jumlah keseluruhan energi kinetik dan potensial yang terkandung dan dimiliki oleh partikel-partikel di dalam gas tersebut dalam skala mikroskopik. Dan, energi dalam gas sebanding dengan suhu mutlak gas. Oleh karena itu, perubahan suhu gas akan menyebabkan perubahan energi dalam gas. 7 Dimana ∆U adalah perubahan energi dalam gas, n adalah jumlah mol gas, R adalah konstanta umum gas (R = 8,31 J mol−1 K−1, dan ∆T adalah perubahan suhu gas (dalam kelvin). Terdapat empat Hukum Dasar yang berlaku di dalam sistem termodinamika, yaitu: Hukum Awal (Zeroth Law) Termodinamika Hukum ini menyatakan bahwa dua sistem dalam keadaan setimbang dengan sistem ketiga, maka ketiganya dalam saling setimbang satu dengan lainnya. Hukum Pertama Termodinamika Hukum ini terkait dengan kekekalan energi. Hukum ini menyatakan perubahan energi dalam dari suatu sistem termodinamika tertutup sama dengan total dari jumlah energi kalor yang disuplai ke dalam sistem dan kerja yang dilakukan terhadap sistem. Hukum kedua Termodinamika Hukum kedua termodinamika terkait dengan entropi. Hukum ini menyatakan bahwa total entropi dari suatu sistem termodinamika terisolasi cenderung untuk meningkat seiring dengan meningkatnya waktu, mendekati nilai maksimumnya. Hukum ketiga Termodinamika Hukum ketiga termodinamika terkait dengan temperatur nol absolut. Hukum ini menyatakan bahwa pada saat suatu sistem mencapai temperatur nol absolut, semua proses akan berhenti dan entropi sistem akan mendekati nilai minimum. Hukum ini juga menyatakan bahwa entropi benda berstruktur kristal sempurna pada temperatur nol absolut bernilai nol. 2.4.1 TERMODINAMIKA I Jika kalor diberikan kepada sistem, volume dan suhu sistem akan bertambah (sistem akan terlihat mengembang dan bertambah panas). Sebaliknya, jika kalor diambil dari sistem, volume dan suhu sistem akan berkurang (sistem tampak mengerut dan terasa lebih dingin). Prinsip ini merupakan hukum alam yang penting dan salah satu bentuk dari hukum kekekalan energi. Sistem yang mengalami perubahan volume akan melakukan usaha dan sistem yang mengalami perubahan suhu akan mengalami perubahan energi dalam. Jadi, kalor yang diberikan kepada sistem akan menyebabkan sistem melakukan usaha dan mengalami perubahan energi dalam. Prinsip ini dikenal sebagai hukum kekekalan energi dalam termodinamika atau disebut hukum I termodinamika. Secara matematis, hukum I termodinamika dituliskan sebagai : 8 Q = W + ∆U Dimana Q adalah kalor, W adalah usaha, dan ∆U adalah perubahan energi dalam. Secara sederhana, hukum I termodinamika dapat dinyatakan sebagai berikut. Jika suatu benda dipanaskan yang berarti diberi kalor Q, benda akan mengembang atau bertambah volumenya yang berarti melakukan usaha W dan benda akan bertambah panas yang berarti mengalami perubahan energi dalam ∆U. Proses Isotermik Suatu sistem dapat mengalami proses termodinamika dimana terjadi perubahan-perubahan di dalam sistem tersebut. Jika proses yang terjadi berlangsung dalam suhu konstan, proses ini dinamakan proses isotermik. Karena berlangsung dalam suhu konstan, tidak terjadi perubahan energi dalam (∆U = 0) dan berdasarkan hukum I termodinamika kalor yang diberikan sama dengan usaha yang dilakukan sistem (Q = W). Proses isotermik dapat digambarkan dalam grafik p – V di bawah ini. Usaha yang dilakukan sistem dan kalor dapat dinyatakan sebagaiDimana V2 dan V1 adalah volume akhir dan awal gas. Proses Isokhorik Jika gas melakukan proses termodinamika dalam volume yang konstan, gas dikatakan melakukan proses isokhorik. Karena gas berada dalam volume konstan (∆V = 0), gas tidak melakukan usaha (W = 0) dan kalor yang diberikan sama dengan perubahan energi dalamnya. Kalor di sini dapat dinyatakan sebagai kalor gas pada volume konstan QV. QV = ∆U Proses Isobarik Jika gas melakukan proses termodinamika dengan menjaga tekanan tetap konstan, gas dikatakan melakukan proses isobarik. Karena gas berada dalam tekanan konstan, gas melakukan usaha (W = p∆V). Kalor di sini dapat dinyatakan sebagai kalor gas pada tekanan konstan Qp. Sebelumnya telah dituliskan bahwa perubahan energi dalam sama dengan kalor yang diserap gas pada volume konstan QV =∆U Dari sini usaha gas dapat dinyatakan sebagai 9 W = Qp − QV Jadi, usaha yang dilakukan oleh gas (W) dapat dinyatakan sebagai selisih energi (kalor) yang diserap gas pada tekanan konstan (Qp) dengan energi (kalor) yang diserap gas pada volume konstan (QV). Proses Adiabatik Dalam proses adiabatik tidak ada kalor yang masuk (diserap) ataupun keluar (dilepaskan) oleh sistem (Q = 0). Dengan demikian, usaha yang dilakukan gas sama dengan perubahan energi dalamnya (W = ∆U). Jika suatu sistem berisi gas yang mula-mula mempunyai tekanan dan volume masing-masing p1 dan V1 mengalami proses adiabatik sehingga tekanan dan volume gas berubah menjadi p2 dan V2, usaha yang dilakukan gas dapat dinyatakan sebagai Dimana γ adalah konstanta yang diperoleh perbandingan kapasitas kalor molar gas pada tekanan dan volume konstan dan mempunyai nilai yang lebih besar dari 1 (γ > 1). Proses adiabatik dapat digambarkan dalam grafik p – V dengan bentuk kurva yang mirip dengan grafik p – V pada proses isotermik namun dengan kelengkungan yang lebih curam. Hukum pertama termodinamika adalah suatu pernyataan mengenai hukum universal dari kekekalan energi dan mengidentifikasikan perpindahan panas sebagai suatu bentuk perpindahan energi. Pernyataan paling umum dari hukum pertama termodinamika ini berbunyi: “ Kenaikan energi internal dari suatu sistem termodinamika sebanding dengan jumlah energi panas yang ditambahkan ke dalam sistem dikurangi dengan kerja yang dilakukan oleh sistem terhadap lingkungannya. ” Pondasi hukum ini pertama kali diletakkan oleh James Prescott Joule yang melalui eksperimen-eksperimennya berhasil menyimpulkan bahwa panas dan kerja saling dapat dikonversikan. Pernyataan eksplisit pertama diberikan oleh Rudolf Clausius pada 1850: "Terdapat suatu fungsi keadaan E, yang disebut 'energi', yang diferensialnya sama dengan jumlah kerja yang dipertukarkan dengan lingkungannya pada suatu proses adiabatik." 2.4.2 TERMODINAMIKA II Hukum kedua termodinamika berkaitan dengan apakah proses-proses yang dianggap taat azas dengan hukum pertama, terjadi atau tidak terjadi di alam. Hukum kedua termodinamika 10 seperti yang diungkapkan oleh Clausius mengatakan, “Untuk suatu mesin siklis maka tidak mungkin untuk menghasilkan efek lain, selain dari menyampaikan kalor secara kontinu dari sebuah benda ke benda lain pada temperatur yang lebih tinggi". Bila ditinjau siklus Carnot, yakni siklus hipotesis yang terdiri dari empat proses terbalikkan: pemuaian isotermal dengan penambahan kalor, pemuaian adiabatik, pemampatan isotermal dengan pelepasan kalor dan pemampatan adiabatik; jika integral sebuah kuantitas mengitari setiap lintasan tertutup adalah nol, maka kuantitas tersebut yakni variabel keadaan, mempunyai sebuah nilai yang hanya merupakan ciri dari keadaan sistem tersebut, tak peduli bagaimana keadaan tersebut dicapai. Variabel keadaan dalam hal ini adalah entropi. Perubahan entropi hanya gayut keadaan awal dan keadaan akhir dan tak gayut proses yang menghubungkan keadaan awal dan keadaan akhir sistem tersebut. Hukum kedua termodinamika dalam konsep entropi mengatakan, "Sebuah proses alami yang bermula di dalam satu keadaan kesetimbangan dan berakhir di dalam satu keadaan kesetimbangan lain akan bergerak di dalam arah yang menyebabkan entropi dari sistem dan lingkungannya semakin besar". Jika entropi diasosiasikan dengan kekacauan maka pernyataan hukum kedua termodinamika di dalam proses-proses alami cenderung bertambah ekivalen dengan menyatakan, kekacauan dari sistem dan lingkungan cenderung semakin besar. Di dalam ekspansi bebas, molekul-molekul gas yang menempati keseluruhan ruang kotak adalah lebih kacau dibandingkan bila molekul-molekul gas tersebut menempati setengah ruang kotak. Jika dua benda yang memiliki temperatur berbeda T1 dan T2 berinteraksi, sehingga mencapai temperatur yang serba sama T, maka dapat dikatakan bahwa sistem tersebut menjadi lebih kacau, dalam arti, pernyataan "semua molekul dalam sistem tersebut bersesuaian dengan temperatur T adalah lebih lemah bila dibandingkan dengan pernyataan semua molekul di dalam benda A bersesuaian dengan temperatur T1 dan benda B bersesuaian dengan temperatur T2". Di dalam mekanika statistik, hubungan antara entropi dan parameter kekacauan adalah, pers. (1): S = k log w dimana k adalah konstanta Boltzmann, S adalah entropi sistem, w adalah parameter kekacauan, yakni kemungkinan beradanya sistem tersebut relatif terhadap semua keadaan yang mungkin ditempati. 11 Jika ditinjau perubahan entropi suatu gas ideal di dalam ekspansi isotermal, dimana banyaknya molekul dan temperatur tak berubah sedangkan volumenya semakin besar, maka kemungkinan sebuah molekul dapat ditemukan dalam suatu daerah bervolume V adalah sebanding dengan V; yakni semakin besar V maka semakin besar pula peluang untuk menemukan molekul tersebut di dalam V. Kemungkinan untuk menemukan sebuah molekul tunggal di dalam V adalah, pers. (2): W1 = c V dimana c adalah konstanta. Kemungkinan menemukan N molekul secara serempak di dalam volume V adalah hasil kali lipat N dari w. Yakni, kemungkinan dari sebuah keadaan yang terdiri dari N molekul berada di dalam volume V adalah, pers.(3): w = w1N = (cV)N. Jika persamaan (3) disubstitusikan ke (1), maka perbedaan entropi gas ideal dalam proses ekspansi isotermal dimana temperatur dan banyaknya molekul tak berubah, adalah bernilai positip. Ini berarti entropi gas ideal dalam proses ekspansi isotermal tersebut bertambah besar. Definisi statistik mengenai entropi, yakni persamaan (1), menghubungkan gambaran termodinamika dan gambaran mekanika statistik yang memungkinkan untuk meletakkan hukum kedua termodinamika pada landasan statistik. Arah dimana proses alami akan terjadi menuju entropi yang lebih tinggi ditentukan oleh hukum kemungkinan, yakni menuju sebuah keadaan yang lebih mungkin. Dalam hal ini, keadaan kesetimbangan adalah keadaan dimana entropi maksimum secara termodinamika dan keadaan yang paling mungkin secara statistik. Akan tetapi fluktuasi, misal gerak Brown, dapat terjadi di sekitar distribusi kesetimbangan. Dari sudut pandang ini, tidaklah mutlak bahwa entropi akan semakin besar di dalam tiap-tiap proses spontan. Entropi kadang-kadang dapat berkurang. Jika cukup lama ditunggu, keadaan yang paling tidak mungkin sekali pun dapat terjadi: air di dalam kolam tiba-tiba membeku pada suatu hari musim panas yang panas atau suatu vakum setempat terjadi secara tiba-tiba dalam suatu ruangan. 2.4.3 TERMODINAMIKA III Efek magnetokalorik di pakai untuk menurunkan temperatur senyawa paramagnetikhingga sekitar 0.001 K. Secara prinsip, temperatur yang lebih rendah lagi dapat dicapai dengan menerapkan efek magnetokalorik berulang-ulang. Jadi setelah penaikan medan magnetik semula secara isoterm, penurunan medan magnetik secara adiabat dapat dipakai untuk menyiapkan 12 sejumlah besar bahan pada temperatur Tᶠ¹, yang dapat dipakai sebagai tandon kalor untuk menaikan tandon kalor secara isoterm ynag berikutnya dari sejumlah bahan yang lebih sedikit dari bahan semula. Penurunan medan magnetik secara adiabat yang kedua dapat menghasilkan temperatur yang lebih rendah lagi, Tᶠ², dan seterusnya. Maka akan timbul pertanyaan apakah efek magnetokalorik dapat dipakai untuk mendinginkan zat hingga mencapai nol mutlak. Pecobaan menunjukan bahwa sifat dasar semua proses pendinginan adalah bahwa semakin rendah temperatur yang dicapai, semakin sulit menurunkannya.hal yang sama berlaku juga untuk efek magnetokalorik.dengan persyaratan demikian, penurunan medan secara adiabat yang tak trhingga banyaknya diperlukan untuk mencapai temperatur nol mutlak. Perampatan dari pengalaman dapat dinyatakan sebagai berikut : Temperatur nol mutlak tidak dapat dicapai dengan sederetan prosesyang banyaknya terhingga.Ini dikenal sebagi ketercapaian temperatur nol mutlak atau ketaktercapaian hukum ketiga termodinamika. Pernyataan lain dari hukum ketiga termodinamika adalahhasil percobaan yang menuju ke perhitungan bahwa bagaimana ΔST berlaku ketika T mendekati nol. ΔST ialah perubahan entropi sistem terkondensasi ketika berlangsung proses isoterm terbuktikan. Percobaansangat memperkuat bahwa ketika T menurun, ΔST berkurang jika sistem itu zat cair atau zat padat. Jadi prinsip berikut dapat di terima: Perubahan entropi yang berkaitan dengan proses-terbalikan-isotermis-suatu sistem- terkondensasi mendekati nol ketika temperaturnya mendekati nol. Pernyataan tersebut merupakan hukum ketiga termodinamika menurut Nernst-Simon. Nernst menyatakan bahwa perubahan entropi yang menyertai tiap proses reversibel, isotermik dari suatu sistem terkondensasi mendekati nol. Perubahan yang dinyatakan di atas dapat berupa reaksi kimia, perubahan status fisik, atau secara umum tiap perubahan yang dalam prinsip dapat dilakukan secara reversibel. Hal ini dikenal sebagai hukun Nernst, yang secara matematika dinyatakan sebagai : Pada Kemudian, Pada tahun 1911, Planck membuat suatu hipotesis 0, bukan hanya beda entropi yg = 0, tetapi entropi setiap zatsuhu T padat atau cair dalam keseimbangan dakhir pada suhu nol. Dapat ditunjukkan secara eksperimen, bahwa bila suhunya mendekati St menurun.0 K, perubahan entropi transisi. Persamaan diatas dikenal sebagai hukum ketiga termodinamika. 13 Hukum ketiga termodinamika terkait dengan temperatur nol absolut. Hukum ini menyatakan bahwa pada saat suatu sistem mencapai temperatur nol absolut, semua proses akan berhenti dan entropi sistem akan mendekati nilai minimum. Hukum ini juga menyatakan bahwa entropi benda berstruktur kristal sempurna pada temperatur nol absolut bernilai nol. St Hukum ketiga termodinamika menyatakan bahwa perubahan entropi yang berkaitan dengan perubahan kimia atau perubahan fisika bahan murni pada T = 0 K bernilai nol. Secara intuitif hukum ketiga dapat dipahami dari fakta bahwa pergerakan ionik atau molekular maupun atomik yang menentukan derajat ketidakteraturan dan dengan demikian juga besarnya entropi, sama sekali berhenti pada 0 K. Dengan mengingat hal ini, tidak akan ada perubahan derajat ketidakteraturan dalam perubahan fisika atau kimia dan oleh karena itu tidak akan ada perubahan entropi. 14 BAB III PENUTUP A. KESIMPULAN BENTUK-BENTUK ENERGI Total energi (E) suatu sistem merupakan jumlah dari energi thermal, mekanis, kinetis, potensial, elektrik, magnetik, kimia dan nuklir. SISTEM, PROSES DAN SIKLUS TERMODINAMIKA Dalam thermodinamika ada dua jenis sistem, yaitu sistem tertutup dan sistem terbuka. Dalam sistem tertutup masa dari sistem yang dianalisis tetap dan tidak ada masa keluar dari sistem atau masuk kedalam sistem, tetapi volumenya bisa berubah. Yang dapatkeluar masuk sistem tertutup adalah energi dalam bentuk panas atau kerja. HUKUM TERMODINAMIKA I,II,III Hukum Pertama Termodinamika: Hukum ini terkait dengan kekekalan energi. Hukum ini menyatakan perubahan energi dalam dari suatu sistem termodinamika tertutup sama dengan total dari jumlah energi kalor yang disuplai ke dalam sistem dan kerja yang dilakukan terhadap sistem. Hukum kedua Termodinamika: Hukum kedua termodinamika terkait dengan entropi. Hukum ini menyatakan bahwa total entropi dari suatu sistem termodinamika terisolasi cenderung untuk meningkat seiring dengan meningkatnya waktu, mendekati nilai maksimumnya. Hukum ketiga Termodinamika: Hukum ketiga termodinamika terkait dengan temperatur nol absolut. Hukum ini menyatakan bahwa pada saat suatu sistem mencapai temperatur nol absolut, semua proses akan berhenti dan entropi sistem akan mendekati nilai minimum. B. SARAN Agar dapat menambah wawasan dan pengetahuan pembaca 15 DAFTAR PUSTAKA http://id.wikipedia.org/wiki/Termodinamika http://www.cuacajateng.com/hukumpertamathermodinamika.html http://www.forumsains.com/fisika-smu/bunyi-hukum-ke-2-thermodynamics/ www.infofisioterapi.com/info/makalah-termodinamika.html http://odimirakoyukieto.blogspot.com/2011/06/makalah-kimia-fisik-termodinamika.html http://termodinamika1.wordpress.com/2007/12/08/materi-perkuliahan/ 16 MAKALAH TERMODINAMIKA SISTEM TERMODINAMIKA Oleh APRILINA D H TURNIP JONRIS MANATTI SITINJAK SARIFAH AINUN SIHOMBING FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS NEGERI MEDAN 2016 17