teoriikatanvalensi
advertisement

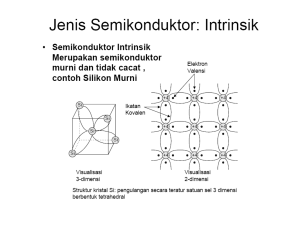
Teori ikatan valensi merupakan teori mekanika kuantum pertama yang muncul pada masa awal penelitian ikatan kimia yang didasarkan pada percobaan W. Heitler dan F. London pada tahun 1927 mengenai pembentukkan ikatan pada molekul hidrogen. Selanjutnya, teori ini kembali diteliti dan dikembangkan oleh Linus Pauling pada tahun 1931 ENAM 6 postulat dasar teori Ikatan Valensi: 1. Ikatan valensi terjadi karena adanya gaya tarik pada elektronelektron yang tidak berpasangan pada atom-atom. 2. Elektron - elektron yang berpasangan memiliki arah spin yang berlawanan. 3. Elektron-elektron yang telah berpasangan tidak dapat membentuk ikatan lagi dengan elektron-elektron yang lain. 4. Kombinasi elektron dalam ikatan hanya dapat diwakili oleh satu persamaan gelombang untuk setiap atomnya. 5. Elektron-elektron yang berada pada tingkat energi paling rendah akan membuat pasangan ikatan-ikatan yang paling kuat. 6. Pada dua orbital dari sebuah atom, orbital dengan kemampuan bertumpang tindih paling banyaklah yang akan membentuk ikatan paling kuat dan cenderung berada pada orbital yang terkonsentrasi itu. Pembentukan Ikatan Kovalen Ada dua jenis orbital dalam pembentukan ikatan kovalen 1. Orbital asli 1. Orbital hibridisasi hibrid yang baru) (bersatunya orbital-orbital atom membentuk orbital Pembentukan Ikatan menggunakan orbital Asli Penerapan Teori Ikatan Valensi pada Molekul Hetero atomik Molekul HCl Penerapan Teori Ikatan Valensi pada Molekul HCl Penerapan Teori Ikatan Valensi pada Molekul H2S Penerapan Teori Ikatan Valensi pada Molekul H2S Penerapan Teori Ikatan Valensi pada Molekul H2O Pembentukan Ikatan menggunakan orbital Hibrida Jumlah atom C lebih dari satu dengan Ikatan Tunggal Jumlah atom C lebih dari satu dengan Ikatan Tunggal Hibridisasi SP2 berguna untuk menjelaskan bentuk struktur molekul trogonal planar. Orbital 2s dan dua orbiotal 2p melakukan hibridisasi ,membentuk tiga orbital sp. Masing-masing terdiri atas 67% karakter p dan 33 % karakter s. Cuping depan mensejajarkan diri membentuk trigonal (segitiga) planar, menghadap sudut segitiga untuk meminimalisasi penolakan elektron