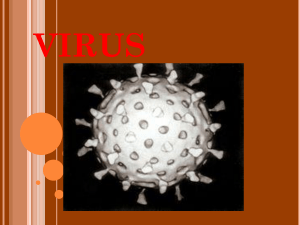
PEDOMAN PELAYANAN LABORATORIUM PEMERIKSAAN
advertisement

PEDOMAN PELAYANAN LABORATORIUM PEMERIKSAAN HEPATITIS KEMETERIAN KESEHATAN REPUBLIK INDONESIA Direktorat Jenderal Bina Upaya Kesehatan Direktorat Bina Pelayanan Penunjang Medik Dan Sarana Kesehatan Tahun 2015 i TIM PENYUSUN Kementerian Kesehatan RI dr. Dyah Armi Riana, MARS Naning Nugrahini, SKM, MKM dr. Wiwi Ambarwati dr. Yulita Evarini Yuzwar, MARS dr. Eva Dian Kurniawati Mai Syafni, SKM Tim Penulis 1. 2. 3. 4. 5. 6. 7. 8. Dr. dr. Rino A Gani, SpPD-KGEH dr. Juferdy Kurniawan, SpPD Anugerah Dwi Handayu, S.T., M.Biomed dr. Fera Ibrahim, M.Sc., SpMK (K)., PH.D Prof. Suzanna Immanuel, SpPK dr. Dewi Wulandari, SpPK., M.Sc dr. Sondang Maryutka Sirait, SpPK Dr. dr. Yuyun SM Soedarmono, M.Sc Departemen Hepatologi RSCM Departemen Hepatologi RSCM Departemen Hepatologi RSCM Mikrobiologi FKUI Departemen Patologi RSCM Departemen Patologi RSCM BBLK Jakarta PMI Pusat Kontributor 1. 2. 3. 4. dr. Rina Sitanggang Eka Irdianty, SKM Gita Ardyani, SKM dr. Andy Omega BBLK Jakarta Global Fund Komponen TB Global Fund Komponen TB Global Fund Komponen TB Sekretariat : Subdit Bina Pelayanan Mikrobiologi dan Imunologi Direktorat Bina Pelayanan Penunjang Medik dan Sarana Kesehatan i DAFTAR GAMBAR Gambar 1. Gambar 2. Gambar Gambar Gambar Gambar 3. 4. 5. 6. Alur Rujukan Pelayanan Laboratorium Pemeriksaan Hepatitis B dan C ............................................................. Algoritma Untuk Penatalaksanaan Diagnostik Hepatitis B ....................................................................... Algoritma Pemeriksaan Diagnostik Hepatitis C ................. Alur Algortima Deteksi Dini Hepatitis B ............................ Algoritma Untuk Uji Saring IMLTD ................................... Proses Penyelenggaraan Tes Panel .................................... 19 21 22 25 30 46 i DAFTAR TABEL Tabel 1. Tabel 2. Kategori Nilai Diagnostik Reagen .......................................... 34 Status Infeksi Sumber Pajanan dan Vaksin Petugas Kesehatan ............................................................... 40 ii DAFTAR ISTILAH Hepatitis VHB VHC HBsAg HBeAg AST ALT EIA CLIA IMLTD PCR NAT : : : : : : : : : : Virus Hepatitis B Virus Hepatitis C Hepatitis B surface Antigen Hepatitis B envelope Antigen Asparlate Aminotransferase Alanine Aminotransferase Enzyme Immunoassay Chemiluminescent Immunoassay Infeksi Menular Lewat Tranfusi Darah Polymerase Chain Reaction adalah suatu teknik sintesis dan amplifikasi DNA secara in vitro : Nucleic acid amplification technology iii DAFTAR ISI DAFTAR DAFTAR DAFTAR BAB I BAB II GAMBAR .......................................................................... TABEL ............................................................................. ISTILAH ........................................................................... PENDAHULUAN ............................................................... 1.1 LATAR BELAKANG ......................................................... 1.2 TUJUAN ......................................................................... 1.3 PENGERTIAN ................................................................. 1.4 RUANG LINGKUP ........................................................... STANDAR PELAYANAN LABORATORIUM PEMERIKSA HEPATITIS B DAN C .................................... 2.1 PEMERIKSAAN SEROLOGI............................................. 2.1.1 RAPID DIAGNOSTIK TEST HEPATITIS B DAN C ... 2.1.1.1 SARANA DAN PRASARANA ...................... 2.1.1.2 KETENAGAAN .......................................... 2.1.1.3 PERALATAN ............................................. 2.1.1.4 EIA/CLIA ................................................. 2.1.1.5 SARANA DAN PRASARANA ...................... 2.1.1.6 KETENAGAAN .......................................... 2.1.1.7 PERALATAN ............................................. 2.2 PEMERIKSAAN MOLEKULER ......................................... 2.2.1 PEMERIKSAAN VIRAL LOAD HEPATITIS B ........... 2.2.1.1 TUJUAN ................................................... 2.2.1.2 SARANA DAN PRASARANA ...................... 2.2.1.3 KETENAGAAN .......................................... 2.2.1.4 PERALATAN ............................................. 2.2.1.5 REAGENSIA ............................................. 2.2.1.6 PROSEDUR PEMERIKSAAN ..................... 2.2.2 PEMERIKSAAN RESISTENSI OBAT ANTIVIRUS HEPATITIS B ........................................................ 2.2.2.1 TUJUAN ................................................... 2.2.2.2 SARANA DAN PRASARANA ...................... 2.2.2.3 KETENAGAAN .......................................... 2.2.2.4 PERALATAN ............................................. 2.2.2.5 REAGENSIA ............................................. 2.2.2.6 PROSEDUR PEMERIKSAAN ..................... 2.2.3 PEMERIKSAAN VIRAL LOAD HEPATITIS C ........... 2.2.3.1 TUJUAN ................................................... 2.2.3.2 SARANA DAN PRASARANA ...................... 2.2.3.3 KETENAGAAN .......................................... 2.2.3.4 PERALATAN ............................................. 2.2.3.5 REAGENSIA ............................................. i ii iii 1 1 2 2 3 4 4 4 4 5 5 5 6 7 7 7 8 8 8 9 9 10 10 10 11 11 11 11 12 12 12 12 13 14 14 14 iv 2.2.3.6 PROSEDUR PEMERIKSAAN ..................... 2.2.4 PEMERIKSAAN GENOTIP VIRUS HEPATITIS C .... 2.2.4.1 TUJUAN ................................................... 2.2.4.2 SARANA DAN PRASARANA ...................... 2.2.4.3 KETENAGAAN .......................................... 2.2.4.4 PERALATAN ............................................. 2.2.4.5 REAGENSIA ............................................. 2.2.4.6 PROSEDUR PEMERIKSAAN ..................... 2.2.5 NUCLEIC ACID AMPLIFICATION TECHNOLOGY (NAT) REAGENT ...................................................... 15 15 15 15 15 16 16 16 BAB III ALUR RUJUKAN PEMERIKSAAN HEPATITIS ................... 3.1 METODE DIAGNOSTIK................................................... 3.1.1 DIAGNOSTIK INFEKSI VIRUS HEPATITIS B ......... 3.1.2 DIAGNOSTIK INFEKSI VIRUS HEPATITIS C ......... 3.1.3 ALGORITMA DIAGNOSTIK ................................... 18 20 20 20 20 BAB IV PEMERIKSAAN HEPATITIS UNTUK UJI SARING .............. 4.1 PEMERIKSAAN HEPATITIS UNTUK DETEKSI DINI PADA PASIEN ........................................................................... 4.1.1 METODE DETEKSI DINI ...................................... 4.1.1.1 METODE UNTUK DETEKSI DINI HEPATITIS B PADA PASIEN ..................... 4.1.1.2 METODE UNTUK DETEKSI DINI HEPATITIS C PADA PASIEN ..................... 4.1.2 ALGORTIMA DETEKSI DINI PASIEN HEPATITIS B ........................................................ 4.2 PEMERIKSAAN HEPATITIS UNTUK UJI SARING PADA DARAH DONOR .............................................................. 4.2.1 INFORMED CONSENT DONOR DARAH ................. 4.2.2 METODE UJI SARING .......................................... 4.2.2.1 METODE UNTUK UJI SARING HEPATITIS B PADA DARAH DONOR .......................... 4.2.2.2 METODE UNTUK UJI SARING HEPATITIS C PADA DARAH DONOR .......................... 4.2.3 ALGORTIMA UJI SARING ..................................... 4.2.4 INTERPRETASI HASIL UJI SARING ...................... 4.2.5 RUJUKAN HASIL UJI SARING REAKTIF ............... 23 BAB V 16 23 23 23 24 25 26 26 26 26 28 29 30 31 EVALUASI DAN PEMILIHAN REAGEN .............................. 33 5.1 EVALUASI REAGEN HEPATITIS ..................................... 33 5.2 PEMILIHAN REAGEN...................................................... 33 v BAB VI BAB VII KEAMANAN DAN KESELAMATAN KERJA ........................ 6.1 MANAJEMEN KEAMANAN KERJA LABORATORIUM ...... 6.1.1 VAKSINASI BAGI PETUGAS LABORATORIUM ...... 6.1.2 PENYEDIAAN SARANA PRASARANA DAN ALAT LABORATORIUM YANG STANDAR ....................... 6.1.3 MANAJEMEN PENGELOLAAN LIMBAH ................ 6.1.4 PEMBENTUKAN TIM K3 LABORATORIUM ........... 6.2 TINDAKAN KEWASPADAAN BAGI PETUGAS LABORATORIUM ............................................................ 6.2.1 PENERAPAN KEWASPADAAN STANDAR .............. 6.2.2 PENGENDALIAN INFEKSI .................................... 6.2.3 PENATALAKSANAAN PASKA PAJANAN ................ 6.2.4 TINDAKAN PASKA PAJANAN ................................ 6.2.5 PROFILAKSIS PASKA PAJANAN ........................... 6.2.6 LAPORAN PAJANAN ............................................. 36 36 37 PEMANTAPAN MUTU ....................................................... 7.1 PEMANTAPAN MUTU INTERNAL .................................... 7.2 PEMANTAPAN MUTU EKSTERNAL ................................. 7.3 PENINGKATAN MUTU .................................................... 42 42 44 46 37 37 38 38 38 38 39 39 40 40 BAB VIII PENUTUP ........................................................................ 47 DAFTAR PUSTAKA ......................................................................... 48 DAFTAR LAMPIRAN ....................................................................... 50 vi BAB I PENDAHULUAN 1.1 LATAR BELAKANG Penyelenggaraan pelayanan laboratorium kesehatan dilaksanakan oleh berbagai laboratorium milik pemerintah dan swasta pada berbagai jenjang pelayanan mulai dari tingkat kecamatan, kabupaten/ kota, propinsi, regional dan nasional, masing-masing laboratorium pada berbagai jenjang pelayanan tersebut mempunyai tugas dan fungsi tersendiri dengan kemampuan pemeriksaan yang berbeda-beda, demikian juga pada pemeriksaan Hepatitis. Penyakit Hepatitis merupakan salah satu masalah dalam kesehatan masyarakat yang terjadi di negara berkembang, salah satunya adalah di Indonesia. Virus Hepatitis B (VHB) setidaknya telah menginfeksi sekitar 2 milyar penduduk di dunia dan diantaranya sekitar 240 juta orang mengidap virus Hepatitis B kronis. Diperkirakan sekitar 170 juta penduduk di dunia terinfeksi virus Hepatitis C dan diperkirakan sekitar 1.500.000 penduduk di dunia meninggal akibat terinfeksi oleh Virus Hepatitis B (VHB) dan Virus Hepatitis C (VHC).1 Berdasarkan data WHO tahun 2012, sekitar 23 juta penduduk di Indonesia terinfeksi oleh virus Hepatitis B dan sekitar 2 juta penduduk di Indonesia telah terinfeksi oleh virus Hepatitis C. Indonesia adalah negara dengan penduduk dengan terinfeksi Hepatitis B tebesar nomor 2 setelah Myanmar diantara negaranegara anggota WHO SEAR (South East Asian Region). Menurut hasil Riskesdas tahun 2007, hasil pemeriksaan Biomedis dari 10.391 sampel serum yang diperiksa, prevalensi HBsAg yang positif adalah 9.4%, yang berarti bahwa diantara 10 penduduk di Indonesia terdapat satu orang terinfeksi virus Hepatitis B. Serta berdasarkan hasil Riskesdas tahun 2013, prevalensi penderita Hepatitis meningkat menjadi 1.2% dari 0.6% di tahun 2007.2 Dalam rangka peningkatan mutu pelayanan laboratorium pemeriksa Hepatitis, maka diperlukan Standar Pelayanan Laboratorium Pemeriksa Hepatitis menurut jenjang dan metode pemeriksaan yang dilakukan oleh fasyankes. 1 1.2 TUJUAN 1. Sebagai pedoman dan acuan bagi pimpinan fasyankes dalam pelayanan laboratorium pemeriksa Hepatitis. 2. Sebagai pedoman dalam melaksanakan pengawasan, pengendalian, pemantauan dan evaluasi pelayanan laboratorium. 3. Sebagai pedoman dalam melaksanakan rujukan dan pemantapan mutu. 1.3 PENGERTIAN 1. Pedoman adalah ukuran tertentu yang dipakai sebagai patokan. 2. Laboratorium klinik adalah laboratorium kesehatan yang melaksanakan pelayanan pemeriksaan dibidang hematologi, kimia klinik, mikrobiologi klinik, parasitologi klinik, imunologi klinik, patologi anatomi dan bidang lain yang berkaitan dengan kepentingan kesehatan perorangan terutama untuk menunjang upaya diagnosis penyakit, penyembuhan penyakit dan pemulihan kesehatan. 3. Laboratorium kesehatan masyarakat adalah laboratorium kesehatan yang melaksanakan pelayanan pemeriksaan dibidang mikrobiologi, fisika, kimia atau bidang lain yang berkaitan dengan kepentingan kesehatan masyarakat dan kesehatan lingkungan terutama untuk menunjang upaya pencegahan penyakit dan peningkatan kesehatan. 4. Puskesmas adalah unit pelaksana pembangunan kesehatan di wilayah kecamatan, yang merupakan satu satuan organisasi yang diberikan kewenangan kemandirian oleh Dinas Kesehatan Kabupaten/ Kota untuk melaksanakan tugas-tugas operasional pembangunan kesehatan di wilayah kecamatan. 5. Puskesmas Pembantu (PUSTU) adalah unit pelayanan kesehatan yang sederhana dan berfungsi menunjang dan membantu melaksanakan kegiatan-kegiatan yang dilakukan Puskesmas dalam ruang lingkup wilayah yang lebih kecil. 6. Balai Besar/ Balai Laboratorium Kesehatan adalah sarana kesehatan yang melaksanakan pelayanan laboratorium kesehatan klinik dan laboratorium kesehatan masyarakat, rujukan, pendidikan dan pelatihan. 7. Rumah Sakit Umum adalah tempat pelayanan yang menyelenggarakan pelayanan medik dasar dan spesialistik, pelayanan penunjang medik, pelayanan instalasi dan pelayanan perawatan secara rawat jalan dan rawat inap. 8. Unit Transfusi Darah (UTD): 2 a. Unit Transfusi Darah Pusat PMI (UTDP-PMI) adalah Unit Transfusi Darah Pusat yang merupakan unit pelayanan teknis transfusi darah yang berkedudukan di Palang Merah Indonesia Pusat. b. Unit Transfusi Darah Daerah PMI (UTDD-PMI) adalah Unit Transfusi Darah Daerah yang merupakan unit pelayanan teknis transfusi darah yang berkedudukan di Palang Merah Indonesia Daerah. c. Unit Transfusi Darah Cabang PMI (UTDC-PMI) adalah Unit Transfusi Darah Cabang yang merupakan unit pelayanan teknis transfusi darah yang berkedudukan di Palang Merah Indonesia Cabang. d. Unit Transfusi Darah Utama (UTD Utama) adalah Unit Transfusi Darah Pusat yang merupakan unit pelayanan teknis transfusi darah yang berkedudukan di pusat. e. Unit Transfusi Darah Madya (UTD Madya) adalah Unit Transfusi Darah di tingkat provinsi yang merupakan unit pelayanan teknis transfusi darah yang ditetapkan dan berkedudukan di provinsi. f. Unit Transfusi Darah Pratama (UTD Pratama) adalah Unit Transfusi Darah di tingkat provinsi, kabupaten dan kota yang merupakan unit pelayanan teknis transfusi darah yang ditetapkan dan berkedudukan di provinsi, kabupaten dan kota. g. Bank Darah Rumah Sakit (BDRS) adalah unit pelayanan di rumah sakit yang bertanggung jawab atas tersedianya darah untuk transfusi yang aman, berkualitas, dan dalam jumlah yang cukup untuk mendukung pelayanan kesehatan di rumah sakit dan fasilitas pelayanan kesehatan lainnya. 1.4 RUANG LINGKUP Ruang lingkup standar pelayanan laboratorium pemeriksa Hepatitis mencakup. 1. Standar Sarana dan Prasarana, SDM, Peralatan Laboratorium Pemeriksa Hepatitis B Dan C. 2. Alur Rujukan Pemeriksaan Hepatitis. 3. Pemantapan Mutu Laboratorium Hepatitis. 4. Pencatatan Dan Pelaporan. 3 BAB II STANDAR PELAYANAN LABORATORIUM PEMERIKSA HEPATITIS B DAN C Jenis pemeriksaan laboratorium Hepatitis B dan C terdiri dari : 2.1 PEMERIKSAAN SEROLOGI 2.1.1 RAPID DIAGNOSTIK TEST HEPATITIS B DAN C Rapid/ Simple single use reagents (Rapid Test) adalah reagen yang memiliki ciri-ciri tersendiri, individual dan sekali pakai. Tampilan reagen ini bisa bermacam-macam. Kebanyakan rapid test berupa imunokromatografi dimana penambahan sampel yang diteteskan akan mengalir lamban ke bagian ujung strip dan bereaksi dengan reagen yang telah terlebih dahulu diimobilisasi. Sampel dapat berupa serum atau plasma atau bahkan pada beberapa reagen bisa menggunakan darah lengkap. Setiap reaksi positif divisualisasikan sebagai bulatan (dot) atau pita (band) yang muncul pada strip pemeriksaan. Semua rapid test harus menyertakan dot atau pita kontrol yang digunakan untuk menilai validitas hasil pemeriksaan. Rapid test disiapkan dalam format yang sangat mudah untuk digunakan yang pada umumnya tidak memerlukan reagen tambahan kecuali semua yang telah disediakan dalam kitnya. Hasil pemeriksaan dibaca dengan mata dan menunjukkan hasil kualitatif dalam beberapa menit. Pembacaan subyektif dan rekaman permanen dari hasil pemeriksaan aslinya tidak dapat disimpan. Rapid test disarankan digunakan pada jumlah sampel yang tidak banyak. 2.1.1.1 SARANA DAN PRASARANA Laboratorium pemeriksa Hepatitis merupakan bagian laboratorium pemeriksa lainnya. Sarana dan prasarana yang dibutuhkan dalam pemeriksaan Hepatitis B dan C dengan rapid test merupakan laboratorium sederhana. Ketentuan mengenai sarana dan prasarana dapat mengacu pada Permenkes No. 37 Tahun 2012 tentang 3 Penyelenggaran Laboratorium Puskesmas. 4 2.1.1.2 KETENAGAAN - Dipimpin oleh 1 (satu) orang dokter terlatih dibidang pemeriksaan Hepatitis B dan C sebagai penanggung jawab. - Petugas teknis adalah ahli teknologi laboratorium medik (D3 analis kesehatan) atau tenaga kesehatan lain yang mendapat pelatihan khusus/ spesifik untuk menangani agen patogen infeksius dan prosedur yang dilakukan. - Petugas administrasi minimal SMU/sederajat. 2.1.1.3 PERALATAN Peralatan yang dibutuhkan oleh laboratorium pemeriksa Hepatitis B dan C dengan rapid test adalah: - Alat-alat keamanan dan keselamatan kerja petugas laboratorium: jas laboratorium sarung tangan masker face shield/ goggles - Alat-alat persiapan dan penyimpanan bahan pemeriksaan: sentrifus lemari pendingin pipet dan disposable tip - Alat pengolahan limbah wadah limbah tajam wadah limbah infeksius wadah limbah non infeksius 2.1.2 EIA/CLIA Enzyme dan chemiluminescent immunoassay saat ini merupakan metode pemeriksaan yang paling umum digunakan untuk tujuan diagnostik atau uji saring infeksi menular lewat transfusi Darah (IMLTD) pada darah donor. Prinsip EIAs dan CLIAs adalah sama. Perbedaannya hanya dalam model deteksi dari kompleks imun yang terbentuk, yakni terbentuknya warna pada EIAs dan pengukuran cahaya yang terbentuk oleh reaksi kimia pada CLIAs. EIA, dengan sensitifitas yang tinggi akan mendeteksi petanda target dari infeksi. Reagen yang telah dievaluasi dengan baik untuk tujuan diagnostik maupun uji saring harus memenuhi 5 standar. EIAs dan CLIAs cocok untuk pemeriksaan sampel dalam jumlah besar dan membutuhkan beberapa peralatan khusus. Pemeriksaan ini bisa dikerjakan secara manual atau sistem otomatik yang spesifik (sistem tertutup). EIAs dan CLIAs mempunyai solid phase yang berbeda untuk melakukan imobilisasi terhadap antigen atau antibodi. Umumnya solid phase yang digunakan adalah: - Bagian dasar atau sisi dari microwell polystirene - Bagian permukaan dari polystirene atau bahan lain - Microparticle - Permukaan dari alat disposable khusus yang digunakan pada sistem reagen otomatik, bervariasi tergantung pabrik, namun umumnya polystyrene. 2.1.2.1 SARANA DAN PRASARANA Tata Ruang a. Lokasi Laboratorium pemeriksaan Hepatitis merupakan bagian laboratorium pemeriksaan lainnya. Area laboratorium harus cukup lapang dengan dinding, langit-langit dan lantai yang terbuat dari bahan yang tidak berpori, mudah dibersihkan dan didesinfeksi serta tahan terhadap bahanbahan kimiawi. b. Ventilasi Laboratorium mempunyai ventilasi yang baik untuk pengendalian infeksi di laboratorium. c. Infrastruktur - Ketersediaan dan ketentuan infrastruktur sesuai dengan pedoman K3. - Tersedia air bersih mengalir, listrik, sanitasi dan pengolahan limbah. - Bak cuci tangan diletakkan dekat pintu ruang laboratorium dan tidak boleh dipakai untuk pembuangan limbah infeksius dan pencucian alat. - Pintu laboratorium jangan dibiarkan dalam keadaan terbuka. - Kontrol suhu dan kelembaban Suhu dan kelembaban laboratorium harus dikendalikan sehingga peralatan dan bahan pemeriksaan bisa terjaga dalam batas toleransi yang direkomendasikan oleh pabrik. 6 2.2 2.1.2.2 KETENAGAAN a. Penanggung Jawab: 1 (satu) orang Dokter Spesialis Patologi Klinik/ Mikrobiologi Klinik/ Dokter yang terlatih dibidang pemeriksaan Hepatitis B dan C. b. Tenaga Teknis: Petugas teknis adalah ahli teknologi laboratorium medik (D3 analis kesehatan). c. Petugas pencatatan dan pelaporan: 1 (satu) orang, minimal SMU/ sederajat. 2.1.2.3 PERALATAN Peralatan yang dibutuhkan oleh laboratorium pemeriksa Hepatitis B dan C dengan EIA dan CLIA adalah:4 a. Alat-alat keamanan dan keselamatan kerja petugas laboratorium: - jas laboratorium - sarung tangan - masker - face shield/ goggles b. Alat-alat persiapan, penyimpanan, dan pemeriksaan: - sentrifus - lemari pendingin - pipet dan disposable tip - washer EIA/CLIA - reader EIA/CLIA - inkubator EIA/CLIA c. Alat pengolahan limbah - wadah limbah tajam - wadah limbah infeksius - wadah limbah non infeksius - wadah limbah cair PEMERIKSAAN MOLEKULER Uji molekuler yang saat ini tersedia untuk diagnosis dan penatalaksanan Hepatitis adalah pengukuran kadar virus, pemeriksaan genotip dan deteksi mutasi resistensi obat antivirus.4 Polymerase Chain Reaction (PCR) adalah suatu teknik sintesis dan amplifikasi DNA secara in vitro. Teknik PCR dapat digunakan untuk mengamplifikasi segmen DNA dalam jumlah besar hanya dalam beberapa jam. Dengan ditemukannya teknik PCR dan sekuensing 7 DNA, telah merevolusi bidang sains dan teknologi khususnya di bidang diagnosa penyakit infeksi. PCR adalah teknik yang cepat dengan sensitivitas dan spesifisitas yang tinggi.5 Kadar DNA VHB dan RNA VHC sebaiknya dilakukan dengan metode real-time PCR dan dilaporkan dalam satuan IU/mL.5 2.2.1 PEMERIKSAAN VIRAL LOAD HEPATITIS B 2.2.1.1 TUJUAN Pemeriksaan ini sangat penting untuk menegakkan diagnosis dan dalam penatalaksanaan Hepatitis B kronik. Pengukuran kadar DNA VHB dalam darah perifer (fraksi serum atau plasma) saat ini merupakan tes yang banyak digunakan, karena merupakan petanda replikasi virus yang dapat dipantau.6 2.2.1.2 SARANA DAN PRASARANA a. Tata ruang - Desain laboratorium harus memastikan keamanan petugas ketika bergerak di area kerja, menggunakan peralatan laboratorium dan melakukan pemeriksaan laboratorium. Perpindahan spesimen dan alur kerja di laboratorium harus meminimalkan kemungkinan hilangnya spesimen, tercampurnya spesimen dan terpaparnya personil laboratorium dari kecelakaan kerja. - Sarana laboratorium harus didesain untuk menjamin keamanan petugas, lingkungan dan kualitas kerja. Ruangan yang sesuai untuk meletakkan peralatan, mempertimbangkan ventilasi dan suhu ruangan. b. Ruangan Area kerja laboratorium harus cukup luas dan dirancang untuk mendukung alur pekerjaan laboratorium yang efisien. c. Kontrol suhu dan kelembaban Suhu dan kelembaban laboratorium harus dikendalikan sehingga peralatan dan bahan pemeriksaan bisa terjaga dalam batas toleransi yang direkomendasikan oleh pabrik. d. Kebersihan 8 Seluruh lantai, dinding, langit-langit dan meja laboratorium harus mudah dibersihkan dan selalu terjaga kebersihannya. e. Area penyimpanan Area penyimpanan harus dialokasikan untuk menyimpan reagen, bahan kontrol, kalibrator dan bahan-bahan laboratorium yang lainnya untuk menjaga kondisi, kemurnian dan stabilitasnya secara adekuat. f. Area Kerja Amplifikasi Molekuler Laboratorium yang tidak menggunakan prosedur amplifikasi molekuler sistim tertutup, harus mempunyai alur kerja satu arah. Ruangan khusus untuk preparasi reagen, preparasi spesimen, amplifikasi, dan deteksi merupakan area yang terpisah satu sama lain. 2.2.1.3 KETENAGAAN a. Penanggung Jawab: 1 (satu) orang Dokter Spesialis Mikrobiologi Klinik/ Patologi Klinik. b. Tenaga Teknis: Petugas teknis minimal S1 dibidang biomedik. c. Petugas pencatatan dan pelaporan: 1 (satu) orang, minimal D3 analis. 2.2.1.4 PERALATAN Peralatan yang diperlukan oleh laboratorium pemeriksa viral load Hepatitis B adalah:4 a. Alat-alat keamanan dan keselamatan kerja petugas laboratorium: - jas laboratorium - sarung tangan - face shield / goggles - safety cabinet class IIa b. Alat-alat persiapan dan penyimpanan bahan pemeriksaan: - refrigerated centrifuge - refrigerator dan deep freezer (minimal -200C) - mikropipet “adjustable” 1000µL, 200µL, 100µL dan disposable tip - vortex mixer c. Alat-alat pemeriksaan: Untuk amplifikasi asam nukleat: 9 - mikropipet “adjustable” dan disposable tip 1000µL, 200µL, 100µL dan 50 µL (3 set) - pencatat waktu terkalibrasi (3 set) - sistem amplifikasi dan deteksi hasil 2.2.1.5 REAGENSIA Reagensia generasi pertama untuk pemeriksaan viral load Hepatitis B dalam darah perifer (serum atau plasma) didasarkan pada teknologi hibridisasi dengan satuan hasil dalam picograms per mililiter. Namun, reagen ini relatif kurang sensitif (sekitar 5,0 log10 kopi/mL), dan linearitas berkisar 5,0 10,0 log10 kopi/mL. Adaptasi teknologi molekuler selanjutnya mengembangkan teknik amplifikasi sinyal dan target yang mengawali perkembangan tes generasi kedua dengan sensitivitas yang lebih tinggi (<200 kopi/mL). Pemeriksaan viral load Hepatitis B generasi terbaru menggunakan real time PCR. Teknik ini terbukti meningkatkan karakteristik kinerja analitik, termasuk batas bawah deteksi, rentang linier yang luas, presisi yang sangat baik dan mengurangi pengenceran spesimen untuk sebagian besar spesimen dengan jumlah virus yang tinggi. Pemeriksaan viral load Hepatitis B harus dilaksanakan dengan reagensia yang tervalidasi dan hasilnya dilaporkan dalam satuan IU/mL. Konversi satuan dari kopi/mL ke IU/mL disesuaikan dengan reagen yang digunakan. 2.2.1.6 PROSEDUR PEMERIKSAAN Pemeriksaan viral load Hepatitis B menggunakan teknik amplifikasi dan hibridisasi asam nukleat seperti Polymerase Chain Reaction (PCR), Hybrid capture, b-DNA dan Real-time PCR. Pemeriksaan harus dilakukan sesuai petunjuk pabrik. 2.2.2 PEMERIKSAAN RESISTENSI OBAT ANTIVIRUS HEPATITIS B Resistensi virus terhadap terapi analog nukleos(t)ida adalah isu yang mempersulit terapi Hepatitis B saat ini. Secara umum, resistensi bisa dibagi atas resistensi genotip atau 10 resistensi fenotip. Resistensi fenotip biasanya bisa dinilai dari adanya kenaikan kembali DNA VHB atau ALT sementara resistensi genotip diketahui dengan melakukan pemeriksaan sekuen gen target. Pemeriksaan terbaik untuk menilai resistensi genotip adalah pemeriksaan DNA VHB direct sequencing yang dapat menilai seluruh kemungkinan mutasi yang terkait resistensi. Saat ini belum disarankan untuk melakukan pemeriksaan resistensi pada semua pasien Hepatitis B, namun pemeriksaan ini bisa dipertimbangkan pada pasien yang gagal mencapai respon yang diharapkan atau pada pasien yang mengalami virologic breakthrough. Peningkatan DNA VHB umumnya mendahului peningkatan ALT dan perubahan strategi terapi lebih awal pada kondisi ini telah terbukti meningkatkan respon. 2.2.2.1 TUJUAN Untuk mendeteksi mutasi penyebab resistensi obat antivirus Hepatitis B. 2.2.2.2 SARANA DAN PRASARANA Fasilitas laboratorium sesuai standar fasilitas laboratorium molekular untuk amplifikasi asam nukleat. 2.2.2.3 KETENAGAAN a. Penanggung Jawab: 1 (satu) orang Dokter Spesialis Mikrobiologi Klinik/ Patologi Klinik. b. Tenaga Teknis: Petugas teknis minimal S1 dibidang biomedik. c. Petugas pencatatan dan pelaporan: 1 (satu) orang, minimal D3 analis. 2.2.2.4 PERALATAN a. Alat-alat keamanan dan keselamatan kerja petugas laboratorium:4 - jas laboratorium - sarung tangan - face shield / goggles - safety cabinet class IIa b. Alat-alat pemeriksaan - pipet serologi 11 - mikropipet “adjustable” 1000µL, 200µL, 100µL, 20 µL, 10 µL, 1 µL - sistem amplifikasi dan deteksi hasil - alat sekuensing 2.2.2.5 REAGENSIA a. Reagensia untuk amplifikasi asam nukleat - Pasangan primer untuk amplifikasi asam nukleat meliputi gen polymerase - Polimerase DNA termostabil - dNTP b. Reagensia untuk sekuensing asam nukleat - Primer sekuensing yang mencakup posisi mutasi penyebab resistensi pada gen polymerase - Dye terminator 2.2.2.6 PROSEDUR PEMERIKSAAN Metoda pemeriksaan: Genotipik (Direct Sequence) 2.2.3 PEMERIKSAAN VIRAL LOAD HEPATITIS C 2.2.3.1 TUJUAN Pemeriksaan molekular Hepatitis C sangat penting dalam mendiagnosis infeksi virus Hepatitis C kronis, karena uji serologi tidak dapat membedakan infeksi kronik dari infeksi yang telah lampau. Pemeriksaan viral load Hepatitis C menggunakan teknik RT-PCR juga terbukti berguna dalam menilai viremia pada pasien dengan tes antibodi positif, mengevaluasi respon pengobatan, dan sebagai tes konfirmasi pada pasien dengan hasil tes serologi negatif palsu.7 Penilaian kadar virus Hepatitis C wajib bagi semua pasien yang akan mendapatkan terapi antivirus. Pemeriksaan viral load Hepatitis C harus menggunakan teknik real-time PCR (nilai deteksi terendah <50 IU/mL untuk dual therapy dan <15 IU/mL untuk triple therapy) dan dinyatakan dalam satuan IU/mL.8 12 2.2.3.2 SARANA DAN PRASARANA a. Tata ruang - Desain laboratorium harus memastikan keamanan petugas ketika bergerak di area kerja, menggunakan peralatan laboratorium dan melakukan pemeriksaan laboratorium. Perpindahan spesimen dan alur kerja di laboratorium harus meminimalkan kemungkinan hilangnya spesimen, tercampurnya spesimen dan terpaparnya personil laboratorium dari kecelakaan kerja. - Sarana laboratorium harus didesain untuk menjamin keamanan petugas, lingkungan dan kualitas kerja. Ruangan yang sesuai untuk meletakkan peralatan, mempertimbangkan ventilasi dan suhu ruangan. b. Ruangan Area kerja laboratorium harus cukup luas dan dirancang untuk mendukung alur pekerjaan laboratorium yang efisien. c. Kontrol suhu dan kelembaban Suhu dan kelembaban laboratorium harus dikendalikan sehingga peralatan dan bahan pemeriksaan bisa terjaga dalam batas toleransi yang direkomendasikan oleh pabrik. d. Kebersihan Seluruh lantai, dinding, langit-langit dan meja laboratorium harus mudah dibersihkan dan selalu terjaga kebersihannya. e. Area penyimpanan Area penyimpanan harus dialokasikan untuk menyimpan reagen, bahan kontrol, kalibrator dan bahan-bahan laboratorium yang lainnya untuk menjaga kondisi, kemurnian dan stabilitasnya secara adekuat. f. Area Kerja Amplifikasi Molekuler Laboratorium yang tidak menggunakan prosedur amplifikasi molekuler sistim tertutup, harus mempunyai alur kerja satu arah. Ruangan khusus untuk preparasi reagen, preparasi spesimen, amplifikasi, dan deteksi merupakan area yang terpisah satu sama lain. 13 2.2.3.3 KETENAGAAN a. Penanggung Jawab: 1 (satu) orang Dokter Spesialis Mikrobiologi Klinik/ Patologi Klinik. b. Tenaga Teknis: Petugas teknis minimal S1 dibidang biomedik. c. Petugas pencatatan dan pelaporan: 1 (satu) orang, minimal D3 analis. 2.2.3.4 PERALATAN Peralatan yang diperlukan oleh laboratorium pemeriksa viral load Hepatitis C adalah:4 a. Alat-alat keamanan dan keselamatan kerja petugas laboratorium: - jas laboratorium - sarung tangan - face shield / goggles - safety cabinet class IIa b. Alat-alat persiapan dan penyimpanan bahan pemeriksaan - refrigerated centrifuge - refrigerator dan deep freezer (minimal -200C) - mikropipet “adjustable” 1000µL, 200µL, 100µL dan disposable tip - vortex mixer c. Alat-alat pemeriksaan: Untuk amplifikasi asam nukleat: - mikropipet “adjustable” dan disposable tip 1000µL, 200µL, 100µL dan 50 µL (3 set) - pencatat waktu terkalibrasi (3 set) - sistem amplifikasi dan deteksi hasil 2.2.3.5 REAGENSIA Berbagai variasi tes kit tersedia untuk mendeteksi atau mengkuantifikasi RNA VHC. Pemeriksaan viral load Hepatitis C didasarkan pada reaksi reverse transcription-polymerase chain reaction (RT-PCR), transcrption-mediated amplification (TMA), bDNA, atau yang baru-baru ini banyak digunakan adalah teknologi real time RT-PCR.6 Pemeriksaan viral load Hepatitis C harus dilaksanakan dengan reagensia yang tervalidasi dan hasilnya dilaporkan dalam satuan IU/mL. 14 2.2.3.6 PROSEDUR PEMERIKSAAN Pemeriksaan viral load Hepatitis C didasarkan pada prinsip amplifikasi target menggunakan metode "klasik" Polymerase Chain Reaction (PCR), "real-time" RT-PCR atau TMA (Transcription-mediated Amplification). RNA VHC diekstraksi dan ditranskripsikan balik menjadi DNA komplementer rantai ganda (cDNA), selanjutnya diproses dengan cyclic enzymatic reaction sehingga menghasilkan generasi dengan sejumlah besar salinan DNA. Pemeriksaan harus dilakukan dengan hati-hati sesuai dengan petunjuk dari pabrik pembuat reagensia yang digunakan dan hasilnya dilaporkan dalam International Unit per mililiter (IU/mL).7 2.2.4 PEMERIKSAAN GENOTIP VIRUS HEPATITIS C Virus Hepatitis C memiliki keragaman genetik yang cukup besar. Ada 6 genotip yang dikenal dan lebih dari 50 subtipe VHC. Nomenklatur yang paling umum digunakan untuk genotip VHC pertama kali diusulkan oleh Simmonds dkk. Sistem klasifikasi ini didasarkan pada perbandingan sekuen nukleotida daerah NS5. Pemeriksaan genotip diperlukan untuk menentukan regimen terapi, durasi terapi dan memprediksi respons terapi. Pemeriksaan ini dapat dilakukan menggunakan berbagai teknik seperti direct sequence analysis, reverse hybridization, dan genotype specific real-time PCR. Saat ini pemeriksaan genotipe yang tersedia sudah mampu mengidentifikasi secara akurat 6 genotipe pada infeksi Hepatitis C kronik.10 2.2.4.1 TUJUAN Untuk menentukan genotipe virus Hepatitis C. 2.2.4.2 SARANA DAN PRASARANA Fasilitas laboratorium sesuai standar fasilitas laboratorium molekular untuk amplifikasi asam nukleat. 2.2.4.3 KETENAGAAN a. Penanggung Jawab: 1 (satu) orang Dokter Spesialis Mikrobiologi Klinik/ Patologi Klinik. 15 b. Tenaga Teknis: Petugas teknis minimal S1 dibidang biomedik. c. Petugas pencatatan dan pelaporan: 1 (satu) orang, minimal D3 analis. 2.2.4.4 PERALATAN a. Alat-alat keamanan dan keselamatan kerja petugas laboratorium:4 - jas laboratorium - sarung tangan - face shield / goggles - safety cabinet class IIa b. Alat-alat pemeriksaan - pipet serologi - mikropipet “adjustable” 1000µL, 200µL, 100µL, 20 µL, 10 µL, 1 µL - sistem amplifikasi dan deteksi hasil 2.2.4.5 REAGENSIA a. Reagensia untuk reverse transcription amplifikasi asam nukleat. b. Reagensia untuk reverse hybridization. 2.2.4.6 dan PROSEDUR PEMERIKSAAN Metoda pemeriksaan: reverse hybridization atau sekuensing sesuai dengan reagen yang digunakan. Pemeriksaan genotype Hepatitis C. 2.2.5 NUCLEIC ACID AMPLIFICATION TECHNOLOGY (NAT) REAGENT Nucleic acid amplification technology (NAT) reagent merupakan reagen molekuler yang didesain untuk uji saring darah donor. Reagen ini mendeteksi keberadaan asam nukleat virus, DNA atau RNA, pada sampel darah donor. Pada teknologi ini, segmen DNA/ RNA yang spesifik dari suatu virus dijadikan target dan diamplifikasi in vitro. Tahapan amplifikasi memungkinkan terdeteksinya virus dengan titer rendah dalam sampel melalui peningkatan jumlah target spesifik ke titer yang dapat dideteksi. Keberadaan asam nukleat yg spesifik mengindikasikan keberadaan virus dan karenanya darah donor kemungkinan infeksius. Uji saring NAT dapat dilakukan pada setiap sampel darah donor untuk mendeteksi asam nukleat dari agen infeksius. 16 Saat ini telah dikembangkan reagen uji saring NAT multipleks yang dapat mendeteksi DNA atau RNA dari beberapa virus secara simultan.10 17 BAB III ALUR RUJUKAN PEMERIKSAAN HEPATITIS Pelayanan laboratorium di fasyankes memiliki kemampuan pemeriksaan yang berbeda sesuai tingkat pelayanannya. Oleh karena itu, agar fasyankes dapat memiliki akses pada pelayanan laboratorium yang terstandarisasi, diperlukan alur rujukan pemeriksaan laboratorium. Berdasarkan Permenkes No. 1647 Tahun 2005 tentang Jejaring Laboratorium Kesehatan, alur rujukan merupakan komponen dalam jejaring laboratorium kesehatan. Jejaring laboratorium ini diperlukan sebagai rujukan pelayanan laboratorium kesehatan dalam bentuk rujukan pemeriksaan/ spesimen, rujukan sarana dan rujukan ilmu pengetahuan/ teknologi. Dalam kaitan dengan pembinaan anggota jejaring laboratorium, maka jejaring laboratorium berfungsi juga sebagai jejaring pemantapan mutu. Tujuan jejaring laboratorium:4 1. Meningkatkan efisiensi pelayanan laboratorium kesehatan. 2. Memperluas jangkauan pelayanan kesehatan. 3. Meningkatkan mutu pelayanan laboratorium kesehatan. 4. Terlaksananya sistem rujukan dalam pelayanan laboratorium kesehatan. Jejaring pelayanan laboratorium pemeriksa Hepatitis disesuaikan berdasarkan jenjang pelayanan yaitu: a. Laboratorium pada fasilitas pelayanan kesehatan primer (Puskesmas, labkesda kabupaten/ kota, Klinik Pratama, dan Laboratorium Klinik Pratama, Rumah Sakit Umum Kelas D), UTD Pratama. Jenis pelayanan Laboratorium pada fasilitas pelayanan kesehatan primer: - Pemeriksaan Hepatitis B dan C dengan rapid diagnostic test (RDT) untuk kepentingan deteksi dini di puskesmas, laboratorium klinik pratama, rumah sakit umum kelas D, dan uji saring untuk UTD pratama. b. Laboratorium pada fasilitas pelayanan kesehatan sekunder (RS kelas C, BLK/ BBLK, Laboratorium Klinik Madya), UTD Madya, Sarana Kesehatan CTKI. Jenis pelayanan laboratorium pada fasilitas pelayanan kesehatan sekunder: - Pemeriksaan Hepatitis B dan C dengan rapid diagnostic test (RDT). - Pemeriksaan Hepatitis B dan C dengan EIA. 18 c. Laboratorium pada fasilitas pelayanan kesehatan tersier (RS kelas A/ B), Laboratorium Klinik Utama), dan UTD Utama. Jenis pelayanan laboratorium pada fasilitas pelayanan kesehatan tersier: - Pemeriksaan Hepatitis B dan C dengan EIA/ CLIA. - Pemeriksaan DNA VHB. - Pemeriksaan RNA VHC. - Pemeriksaan NAT. d. Laboratorium Rujukan Nasional Laboratorium Rujukan Nasional ditetapkan oleh Kementerian Kesehatan untuk melakukan tugas dan fungsi tertentu meliputi: - Evaluasi reagen Hepatitis. - Penyelenggaraan PME Laboratorium Hepatitis. - Pemeriksaan molekuler dan resistensi - Pembinaan dan peningkatan kapasitas. Laboratorium Fasyankes Primer Metode Pemeriksaan: Rapid Diagnostic Test Tujuan Pemeriksaan: Deteksi dini Laboratorium Fasyankes Sekunder* Metode Pemeriksaan: EIA/CLIA Tujuan Pemeriksaan: Diagnostik, Inisiasi Terapi Laboratorium Fasyankes Tersier Metode Pemeriksaan: EIA/CLIA, Molekuler Tujuan Pemeriksaan: Diagnostik, Inisiasi Terapi, Pemantauan Terapi Laboratorium Rujukan Nasional Metode Pemeriksaan: Molekuler + Resistensi Gambar 1. Alur Rujukan Pelayanan Laboratorium Pemeriksa Hepatitis B dan C Catatan: *Jika di laboratorium fasyankes sekunder tidak tersedia pemeriksaan DNA VHB dan RNA VHC untuk inisiasi dan pemantauan terapi maka perlu dilakukan rujukan spesimen ke fasilitas yang lebih tinggi. 19 3.1 METODE DIAGNOSTIK 3.1.1 DIAGNOSIS INFEKSI VIRUS HEPATITIS B Diagnosis Hepatitis B ditegakkan dengan pemeriksaan biokimia dan serologi.11 Pada infeksi akut, kadar AST dan ALT akan meningkat hingga 3-10 kali batas atas normal. HBsAg merupakan petanda serologis pertama yang terdeteksi 2-12 minggu setelah pejanan. HBeAg akan muncul bersamaan atau beberapa saat setelah munculnya HBsAg dalam darah. Antibodi terhadap HBeAg akan segera muncul setelah hilangnya HBeAg. Pada Hepatitis B akut, anti-HBc akan muncul 2 minggu setelah HBsAg terdeteksi. Pada infeksi virus Hepatitis B kronik didefinisikan sebagai ditemukannya HBsAg dalam serum selama lebih dari 6 bulan. Terdeteksinya HBeAg menunjukkan infektivitas yang tinggi. Konsentrasi DNA VHB juga digunakan sebagai salah satu prediktor respons pada pasien yang menerima terapi antiviral.11 3.1.2 DIAGNOSIS INFEKSI VIRUS HEPATITIS C Pada infeksi Hepatitis C akut, RNA VHC dapat terdeteksi pada hari ke 7-10 setelah paparan dan anti-HCV akan terdeteksi didalam darah 2-8 minggu setelah paparan. Diagnosis Hepatitis C akut dapat ditegakkan jika terjadi serokonversi anti-HCV pada pasien yang sebelumnya telah diketahui anti-HCV negatif, oleh karena tidak adanya petanda serologi yang dapat membuktikan infeksi akut VHC. Pada Hepatitis C kronik, diagnosis dapat ditegakkan apabila anti-HCV dan RNA VHC tetap terdeteksi lebih dari 6 bulan sejak terinfeksi disertai dengan gejala-gejala penyakit hati kronik.12 3.2 ALGORITMA DIAGNOSTIK Seseorang yang diduga terpapar virus Hepatitis B dapat diuji untuk berbagai petanda diagnostik, setiap pemeriksaan yang dilakukan tergantung pada riwayat klinis penderita, gejala dan hasil tes sebelumnya.13 Pola pemeriksaan serologis umum dan virologi yang dapat diamati pada pasien dengan infeksi VHB akut dan kronik ditampilkan pada gambar berikut (Gambar 2).13 20 HBsAg HBsAg Positif HBsAg Negatif Anti HBc (IgG/IgM) Anti HBs Anti HBc IgG Anti HBc IgM Anti HBs Positif Anti HBs Negatif Anti HBc IgG (+), DNA VHB (+) Anti HBc IgM (INFEKSI AKUT) VAKSINASI INFEKSI KRONIK HBsAg (-), Anti HBs (+), Anti HBc IgG (+), DNA VHB (-) Proteksi (Kemungkinan berasal dari alami atau vakisinasi) SEMBUH SPONTAN Gambar 2. Algoritma Untuk Penatalaksanaan Diagnostik Hepatitis B5 Sedangkan pada infeksi virus Hepatitis C kronik, diawali dengan pemeriksaan antibodi virus Hepatitis C dalam darah secara rapid. Hasil reaktif harus dilanjutkan dengan pemeriksaan RNA VHC (metoda PCR atau NAT).13 Gambar 3 merupakan algoritma pemeriksaan yang digunakan sebagai panduan untuk penanganan awal dan pelayanan publik untuk pemeriksaan virus Hepatitis C (VHC). 21 Anti-HCV (-) STOP Kecuali HD, HIV, Populasi/ Imunosupresan (+) RNA VHC Cek RNA VHC (-) (+) Ulang RNA VHC 1 bulan kemudian Evaluasi Medis Gambar 3. Algoritma Pemeriksaan Diagnostik Hepatitis C - - No. 1. 2. Untuk pemeriksaan uji saring yang dilakukan dilayanan tingkat dasar menggunakan metode RDT. Untuk hasil pemeriksaan uji saring ditulis dengan hasil reaktif dan non reaktif. Sedangkan untuk diagnostik dilakukan pemeriksaan dengan menggunakan pemeriksaan molekuler. Untuk diagnostik Hepatitis B yang diperiksa adalah DNA VHB dan untuk diagnostik Hepatitis C yang diperiksa adalah RNA VHC. Hasil pemeriksaan diagnostik ditulis dengan hasil positif dan negatif. Jenis Pemeriksaan Uji Saring Diagnostik Metode Pemeriksaan RDT Molekuler Hasil Pemeriksaan Reaktif Non Reaktif Positif Negatif 22 BAB IV PEMERIKSAAN HEPATITIS UNTUK UJI SARING 4.1 PEMERIKSAAN HEPATITIS UNTUK DETEKSI DINI PADA PASIEN Hepatitis B dan Hepatitis C merupakan infeksi Hepatitis B Virus (HBV) dan Hepatitis C Virus (HCV) yang dapat ditularkan melalui transfusi darah, hubungan seksual, penggunaan jarum suntik bekas, tindakan medis invasif, dan khusus Hepatitis B ditularkan dari ibu kepada bayi. Penyakit Hepatitis B dan C seringkali tanpa gejala yang khas dan biasanya pasien tidak menyadari hingga pada saat pemeriksaan kesehatan rutin atau melakukan pemeriksaan laboratorium untuk keperluan yang lain. Pemeriksaan deteksi dini Hepatitis B dan C ditujukan untuk mendeteksi apakah seseorang terinfeksi Hepatitis B atau C. Pemeriksaan deteksi dini Hepatitis B juga diperlukan pada saat akan dilakukan vaksinasi VHB. 4.1.1 METODE DETEKSI DINI 4.1.1.1 METODE UNTUK DETEKSI DINI HEPATITIS B PADA PASIEN Seseorang yang terinfeksi Hepatitis B, didalam darahnya mengandung sejumlah besar HBsAg yang dihasilkan secara berlebihan oleh VHB yang bereplikasi. Oleh karenanya deteksi dini terhadap HBsAg merupakan deteksi apakah seseorang terinfeksi Hepatitis B. Adanya antibodi terhadap antigen surface HBV (anti-HBs) merupakan petanda adanya respon imun terhadap infeksi HBV, baik yang berasal dari infeksi maupun pasca vaksinasi. Untuk deteksi keberadaan HBsAg dapat digunakan metoda serologi, yakni EIA atau CLIA atau Rapid Test, sedangkan untuk deteksi keberadaan antiHBs, saat ini bisa dilakukan dengan menggunakan metoda EIA atau CLIA. Lebih lanjut dengan kemajuan teknologi dalam bidang biomolekuler, telah dikembangkan metoda molekuler untuk mendeteksi keberadaan DNA VHB dengan PCR DNA. Beberapa hal yang perlu diperhatikan dalam melakukan deteksi dini pada pasien, hal-hal berikut disarankan dilaksanakan:14 1. Uji saring dengan rapid test HBsAg yang sangat sensitif dan spesifik bisa dilakukan di 23 laboratorium dengan jumlah pemeriksaan kurang dari 60 pemeriksaan/minggu, di daerah terpencil atau pada keadaan darurat. 2. Deteksi dini harus dilakukan menggunakan imunoreagen HBsAg yang sangat sensitif dan spesifik (misalnya metoda EIA/ CLIA). Reagen harus mampu mendeteksi subtipe HBV yang spesifik di negara yang bersangkutan. 3. Deteksi dini untuk anti-HBc tidak direkomendasikan secara rutin. Setiap negara harus menetapkan kebutuhan deteksi dini antiHBc atas dasar prevalensi dan insidensi infeksi HBV. 4. Deteksi dini terhadap ALT tidak direkomendasikan. 4.1.1.2 METODE UNTUK DETEKSI DINI HEPATITIS C PADA PASIEN Seseorang yang terinfeksi Hepatitis C, sering tidak menunjukkan gejala dan cenderung berkembang menjadi penyakit hati kronis hingga hepatoma (kanker hati). Adanya antibodi terhadap virus Hepatitis C (anti-HCV) merupakan petanda adanya respon imun terhadap infeksi HCV dan dipakai sebagai petanda infeksi HCV. Untuk deteksi keberadaan anti-HCV dapat digunakan metoda serologi, yakni Rapid Test atau EIA atau CLIA. Untuk memastikan diagnosis dilanjutkan dengan pemeriksaan RNA VHC yang menggunakan metode PCR dan diikuti dengan pemeriksaan genotip. Beberapa hal yang perlu diperhatikan dalam melakukan deteksi dini pada pasien, hal-hal berikut disarankan dilaksanakan: 1. Deteksi dini dengan rapid test anti-HCV yang sangat sensitif dan spesifik bisa dilakukan di laboratorium dengan jumlah pemeriksaan kurang dari 60 pemeriksaan/minggu, di daerah terpencil atau pada keadaan darurat. 2. Deteksi dini harus dilakukan menggunakan imunoreagen anti-HCV yang sangat sensitif dan spesifik (misalnya metoda EIA/ CLIA). 24 Ringkasan tentang petanda uji saring, reagen dan rekomendasi untuk digunakan di laboratorium dapat dilihat pada Tabel 1 (lampiran 1).15 4.1.2 ALGORITMA DETEKSI DINI PASIEN HEPATITIS B HBsAg Non Reaktif HbsAg Negatif Reaktif Retest Reaktif Konfirmasi HBsAg Non Reaktif Reaktif HbsAg Negatif HbsAg Positif Gambar 4. Alur Algoritma Deteksi Dini Hepatitis B Interpretasi hasil uji saring:? Bila hasil uji saring pertama reaktif, lakukan sentrifugasi ulang pada sampel dengan kecepatan 10.000 rpm selama 5 menit. Baru dilakukan pemeriksaan duplo (dua kali). Bila hasil tetap reaktif, disarankan untuk pemeriksaan konfirmasi menggunakan HbsAg confirmatory reagent. Bila hasil tetap reaktif, dilaporkan sebagai hasil reaktif. Bila fasyankes tidak memiliki sarana peralatan ultrasentrifugasi atau confirmatory, segera rujuk pasien ke rumah sakit rujukan terdekat untuk pemeriksaan konfirmasi dan pengobatan. 25 4.2 PEMERIKSAAN HEPATITIS UNTUK UJI SARING PADA DARAH DONOR Hepatitis B dan Hepatitis C merupakan infeksi Hepatitis B virus (HBV) dan Hepatitis C virus (HCV) yang dapat ditularkan melalui transfusi Darah. Di Indonesia, kewajiban tentang uji saring Infeksi Menular Lewat Transfusi Darah (IMLTD) pada semua kantong darah yang dikumpulkan terhadap HIV, Hepatitis B, Hepatitis C dan sifilis telah dituangkan di dalam Peraturan Pemerintah No. 7 tahun 2011 tentang Pelayanan Darah, khususnya pada Pasal 11. Uji saring IMLTD terhadap darah donor bertujuan untuk meminimalkan risiko penularan IMLTD pada pasien yang menerima transfusi darah. 4.2.1 INFORMED CONSENT DONOR DARAH Penyumbangan Darah merupakan tindakan medis pengambilan sejumlah darah dari vena donor kedalam kantong darah yang memiliki risiko. Ketentuan terkait pengambilan darah tertera di dalam Peraturan Pemerintah Nomor 7 tahun 2011 tentang Pelayanan Darah, khususnya Bagian Ketiga Pasal 9. Peraturan Pemerintah tersebut menyatakan bahwa pengambilan darah harus dilakukan di Unit Transfusi Darah (UTD) pada donor yang sehat yang memberikan persetujuan. Untuk mendapatkan persetujuan donor, donor harus diberikan informasi terlebih dahulu mengenai risiko pengambilan darah dan hasil pemeriksaan darahnya. Apabila hasil pemeriksaan darah reaktif, maka UTD harus menganjurkan kepada yang bersangkutan untuk sementara tidak mendonorkan darah dan segera melakukan pemeriksaan diagnostik untuk mendapatkan penanganan lebih lanjut. Setelah donor memahami bahan edukasi dan mengisi kuesioner donor terkait riwayat kesehatannya, sebagai tanda persetujuan donor atas pengambilan darah, uji saring infeksi dan kesediaan untuk diberitahu hasil uji saring terhadap darahnya, donor harus membubuhkan tanda tangan pada formulir informed consent yang sudah disediakan. Terlampir contoh informed consent donor darah (lampiran 2). 4.2.2 METODE UJI SARING 4.2.2.1 METODE UNTUK UJI SARING HEPATITIS B PADA DARAH DONOR Hepatitis B merupakan salah satu jenis IMLTD yang prevalensinya paling tinggi dibandingkan dengan 26 Hepatitis C dan HIV pada darah donor. Hal ini terkait dengan tingginya prevalensi HBsAg positif diantara populasi umum di Indonesia, yakni 9,4%.16 Oleh karenanya Indonesia dikelompokan kedalam negara dengan prevalensi Hepatitis B sedang hingga tinggi. Tahun 2013, prevalensi HBsAg reaktif pada Darah donor di Indonesia adalah 1,56%.17 Seseorang yang terinfeksi Hepatitis B, di dalam darahnya mengandung sejumlah besar HBsAg yang dihasilkan secara berlebihan oleh HBV yang bereplikasi. Oleh karenanya uji saring terhadap HBsAg merupakan upaya pengamanan darah terhadap Hepatitis B yang paling umum dilaksanakan. Namun demikian, beberapa negara lain ada juga yang melakukan uji saring pada antibodi terhadap antigen core HBV (anti-HBc) sebagai petanda paparan terhadap HBV dan antibodi terhadap antigen surface HBV (anti-HBs) sebagai petanda adanya respon imun terhadap infeksi HBV. Untuk deteksi keberadaan HBsAg dapat digunakan metoda serologi, yakni EIA atau CLIA atau Rapid Test, sedangkan untuk deteksi keberadaan anti-HBc dan atau anti-HBs, saat ini bisa dilakukan dengan menggunakan metoda EIA atau CLIA. Atas dasar beberapa data tersebut di atas, untuk meminimalkan risiko infeksi HBV melalui transfusi di Indonesia, hal-hal berikut disarankan dilaksanakan:14 1. Uji saring harus dilakukan menggunakan imunoreagen HBsAg yang sangat sensitif dan spesifik. Reagen harus mampu mendeteksi subtipe HBV yang spesifik di negara yang bersangkutan. 2. Uji saring dengan rapid test HBsAg yang sangat sensitif dan spesifik bisa dilakukan di laboratorium dengan jumlah pemeriksaan kurang dari 60 pemeriksaan/minggu), di daerah terpencil atau pada keadaan darurat. 3. Uji saring untuk anti-HBc tidak direkomendasikan secara rutin. Setiap negara harus menetapkan kebutuhan uji saring anti- 27 HBc atas dasar prevalensi dan insidensi infeksi HBV. Indonesia merupakan negara dengan tingkat endemisitas infeksi HBV sedang hingga tinggi, sehingga uji saring anti-HBc akan reaktif pada sekitar 33,7% sampel HBsAg negatif yang belum tentu semuanya benar-benar infeksius. Hal ini akan menyebabkan banyak darah yang dibuang. 4. Uji saring terhadap ALT tidak direkomendasikan. 5. Uji saring dengan NAT dilakukan untuk meningkatkan keamanan darah, namun perlu memperhatikan aspek pembiayaan dan ketersediaan logistik. 4.2.2.2 METODE UNTUK UJI SARING HEPATITIS C PADA DARAH DONOR Hepatitis C merupakan jenis IMLTD yang prevalensinya menempati tertinggi kedua setelah Hepatitis B pada darah donor. Infeksi HCV pada seseorang akan merangsang tubuh untuk membuat antibodi berupa anti-HCV. Pada tahun 2013, prevalensi anti-HCV reaktif pada darah donor di Indonesia adalah 0,39%.17 Untuk deteksi keberadaan anti-HCV dapat digunakan metoda serologi berupa EIA, CLIA atau Rapid Test dan untuk deteksi keberadaan RNA VHC dapat digunakan metoda molekuler NAT multipleks yang diikuti dengan NAT HCV diskriminatori. Untuk meminimalkan risiko infeksi HCV melalui transfusi di Indonesia, hal-hal berikut disarankan dilaksanakan: 1. Uji saring harus dilakukan menggunakan imunoreagen anti-HCV atau imunoreagen kombinasi Antibodi-Antigen HCV yang sangat sensitif dan spesifik. Reagen harus mampu mendeteksi subtipe HCV yang spesifik di negara yang bersangkutan. 2. Uji saring dengan rapid test anti-HCV yang sangat sensitif dan spesifik bisa dilakukan di laboratorium dengan beban kerja sedikit, di daerah terpencil atau pada keadaan darurat. 3. Uji saring dengan NAT dilakukan untuk meningkatkan keamanan darah, namun perlu 28 memperhatikan aspek ketersediaan logistik. pembiayaan dan Untuk lebih lengkapnya, ringkasan tentang petanda uji saring, reagen dan rekomendasi untuk empat jenis IMLTD dapat dilihat pada Tabel 1 (lampiran 1). 4.2.3 ALGORITMA UJI SARING Terdapat dua pilihan algoritma uji saring yang 16 direkomendasikan tergantung pada sudah atau belum diterapkannya sistem kualitas yang efektif di laboratorium uji saring IMLTD. Kedua pilihan algortima tersebut adalah: Pilihan 1: Algoritma uji saring IMLTD dimana sistem kualitas di laboratorium terbatas. a. Gunakan reagen tunggal (misalnya reagen A), dan lakukan pemeriksaan terhadap sampel satu kali sesuai dengan prosedur kerja standar. Reagen untuk setiap IMLTD harus divalidasi terlebih dahulu. b. Analisa hasil pemeriksaan. Jika hasilnya non reaktif (A-), darah dapat dikeluarkan untuk transfusi. c. Jika hasilnya initial reactive (A+), segera pisahkan dan musnahkan darah yang disumbangkan dan komponen darah yang dihasilkan. Pilihan 2: Algoritma uji saring IMLTD dimana sistem kualitas di laboratorium efektif. a. Gunakan reagen tunggal (misalnya reagen A), dan lakukan pemeriksaan terhadap sampel satu kali sesuai dengan prosedur kerja standar. Assay untuk setiap IMLTD harus divalidasi terlebih dahulu. b. Analisa hasil pemeriksaan. Jika hasilnya non reaktif (A-), darah dapat dikeluarkan untuk penggunaan klinis. c. Jika hasilnya initial reactive (A +), segera pisahkan darah yang disumbangkan dan komponen darah yang dihasilkan. d. Ulangi pemeriksaan secara ganda (in duplicate), dari sampel yang sama menggunakan reagen yang sama; Analisa hasil dari pemeriksaan ulang: - Jika kedua pemeriksaan ulang non reaktif (A+, A-, A-), maka hasil initial mungkin adalah reaktif palsu atau 29 ada kesalahan teknis dan darah dapat dikeluarkan untuk penggunaan klinis. - Jika salah satu atau kedua hasil pemeriksaan ulang reaktif (A+, A+, A-) atau (A+, A+, A+), maka hasil dikatakan positif, segera pisahkan dan musnahkan darah yang disumbangkan dan komponen darah yang dihasilkan. Rujuk donor ke bagian penyakit dalam rumah sakit rujukan pemerintah terdekat atau yang ditunjuk untuk mendapatkan pemeriksaan diagnostik. Ke dua pilihan algoritma dapat dilihat pada gambar di bawah ini: Non Reaktif (A-) Keluarkan darah & komponen darah yang dihasilkan Lakukan uji saring inisial (A) Initial Reactive (A+) Pilihan 1 Pilihan 2 (Sistem Kualitas tidak ada/terbatas) Musnahkan darah dan komponen darah yang dihasilkan (Sistem Kualitas efektif) Ulangi uji saring in duplicate dengan sampel dan assay yang sama Negatif pada ke-dua pemeriksaan ulang (A+, A-, A-) Keluarkan darah & komponen darah yang dihasilkan Gambar 5. Reaktif pada salah satu atau kedua pemeriksaan ulang (A+, A+, A-) atau (A+, A+, A+) Musnahkan darah dan komponen darah yang dihasilkan Rujuk donor ke bagian penyakit dalam rumah sakit rujukan pemerintah terdekat atau yang ditunjuk untuk mendapatkan pemiksaan diagnostik 15 4.2.4 INTERPRETASI HASIL UJI SARING Uji saring terhadap IMLTD pada darah donor bertujuan untuk menentukan darah mana yang dapat ditransfusikan yang kemungkinan penularan IMLTD nya seminimal mungkin. Oleh karena itu hasil uji saring inisial atau pertama kali dinyatakan dengan reaktif dan non reaktif. Reaktif artinya darah mengandung antibodi dan atau antigen agen infeksius yang dideteksi, sehingga darah tidak aman untuk ditransfusikan, dan harus dimusnahkan sesuai standar. Sedangkan non reaktif artinya darah tidak mengandung antibodi dan atau antigen agen infeksius yang dideteksi, sehingga darah aman untuk ditransfusikan. Sedemikian pentingnya tujuan dari uji 30 saring ini, maka reagensia yang digunakan harus memiliki sensitifitas setinggi mungkin agar kemungkinan hasil negatif palsu dapat dihindarkan. 4.2.5 RUJUKAN HASIL UJI SARING REAKTIF Donor dengan hasil uji saring darah ulang positif perlu dirujuk ke bagian penyakit dalam rumah sakit yang mampu melakukan layanan Hepatitis terdekat atau yang ditunjuk untuk mendapatkan pemeriksaan diagnostik agar dapat ditetapkan status infeksinya. Rujukan kepada rumah sakit dilakukan secara tertulis, setelah sebelumnya donor diundang ke UTD untuk mendapatkan penjelasan dan konseling tentang hasil uji saring darahnya. Konseling ditujukan agar donor setuju dan bersedia untuk dirujuk ke rumah sakit untuk memperoleh pemeriksaan diagnostik. Umpan balik hasil tes diagnostik dari rumah sakit kepada UTD hanya akan dilakukan terhadap hasil tes diagnostik negatif, sedangkan untuk hasil tes diagnostik positif tidak dilakukan umpan balik hasil kepada UTD oleh karena hasil tes diagnostik merupakan informasi rahasia yang hanya bisa diberikan kepada pasien yang bersangkutan. Umpan balik hasil tes diagnostik dapat dijadikan bahan untuk menentukan status penyumbangan darah dari donor terkait. Jika donor sudah dirujuk ke rumah sakit untuk mendapatkan tes diagnostik dan tidak ada hasil umpan balik tes diagnostik dari rumah sakit, maka UTD dapat menetapkan status donasi donor yang bersangkutan berupa penolakan permanen yakni donor tidak diperkenankan untuk menyumbangkan darahnya lagi kecuali bukti klinis dan laboratoris dari Dokter dan rumah sakit menunjukan adanya penyembuhan. Sedangkan apabila hasil pemeriksaan diagnostik menunjukkan hasil negatif, maka darah yang telah disumbangkan tetap tidak bisa digunakan untuk transfusi, sementara penentuan boleh tidaknya donor yang bersangkutan menyumbangkan darahnya kembali ditetapkan dari hasil uji saring tiga bulan kemudian saat donor menyumbangkan darahnya kembali. Perbedaan hasil antara uji saring dengan pemeriksaan diagnostik sangat mungkin terjadi oleh karena reagen uji saring memiliki sensitifitas yang tinggi sehingga memiliki kemungkinan hasil positif palsu. Oleh karena itu pemeriksaan diagnostik harus dilakukan melalui algoritma yang standar 31 melibatkan 2-3 jenis reagensia yang berbeda metoda dan formatnya. 32 BAB V EVALUASI DAN PEMILIHAN REAGEN HEPATITIS 5.1 EVALUASI REAGEN HEPATITIS Reagen yang diproduksi oleh perusahaan bertaraf internasional pada umumnya telah didesain dengan baik dan umumnya telah dievaluasi secara ilmiah, baik oleh pabriknya maupun laboratorium independen. Namun demikian, perlu dilakukan evaluasi reagen dengan menggunakan spesimen penduduk Indonesia dan secara berkala dilakukan secara terencana dengan baik dan terdokumentasi penting, untuk menjamin agar pemilihan reagen yang paling tepat dari sekian pilihan yang ada dapat dibuat. Evaluasi dilakukan sebelum pengadaan dan secara berkala dievaluasi ulang setiap periode 5 tahun atau bilamana terjadi banyak hasil yang tidak sesuai antara hasil deteksi dini dan uji saring dengan hasil pemeriksaan di Rumah Sakit Rujukan. Hasil evaluasi reagen membantu pemilihan reagen sesuai dengan kebutuhan. Evaluasi dan penetapan rekomendasi reagen harus dilakukan di laboratorium yang memiliki fasilitas, tenaga ahli, pengalaman dan yang paling penting adalah panel sampel. Oleh karena itu evaluasi hanya dapat dilakukan oleh laboratorium yang ditunjuk oleh Kementerian Kesehatan. 5.2 PEMILIHAN REAGEN Setiap tujuan pemeriksaan memiliki kelebihan dan keterbatasan yang perlu dijadikan bahan pertimbangan ketika memilih reagen. Oleh karenanya algoritma dari pemeriksaan berperan penting. Beberapa keterbatasan reagen adalah: a. Masa jendela infeksi b. Derajat positif palsu biologis c. Kompleksitas beberapa reagen yang membutuhkan instrumen khusus. Faktor spesifik yang harus dipertimbangkan dalam memilih reagen: Kejelasan prosedur pemeriksaan Kemudahan penggunaan Karakteristik reagen termasuk sensitivitas dan spesifisitas Jenis dan volume sampel yang digunakan Akurasi, presisi dan reprodusibilitas reagen Jumlah tes per kit Total waktu pemeriksaan 33 Kesuaian jenis reagen dengan peralatan yang digunakan Kondisi penyimpanan reagen Faktor laboratorium yang harus dipertimbangkan dalam memilih reagen: Jumlah sampel yang akan diperiksa Kompetensi petugas Ketersediaan alat Sarana dan prasarana yang memenuhi syarat Pemantapan mutu laboratorium Faktor logistik yang harus dipertimbangkan dalam memilih reagen: Seleksi dan validasi pemasok Harga Sistem pengadaan Masa kadaluarsa Infrastruktur, misalnya kondisi penyimpanan yang terkontrol dan listrik yang tidak terganggu Dukungan teknis untuk pemecahan masalah Pemeliharaan alat, pelayanan dan perbaikan Memilih reagen yang tepat merupakan bagian penting dalam program pemeriksaan diagnostik maupun uji saring. Hasil pemeriksaan diagnostik maupun uji saring yang dapat dipercaya tergantung pada konsistensi penggunaan reagen yang efektif dan telah divalidasi dengan baik. Berikut adalah kategori nilai diagnostik reagen Tabel 1. Kategori Nilai Diagnostik Reagen Kategori Sensitivitas (%) Sangat tinggi >= 95 Tinggi 80-94 Sedang 65-79 Rendah 50-64 Sangat rendah < 50 34 Pemilihan reagen yang akan digunakan sensitivitas dan spesifisitas yang paling tinggi. berdasarkan nilai 35 BAB VI KEAMANAN DAN KESELAMATAN KERJA Bekerja menangani bahan biologik berpotensi mendapat risiko bahaya terpapar dan terinfeksi agen infeksius yang terkandung di dalamnya. Petugas laboratorium memiliki risiko terpapar dan terinfeksi Hepatitis B dan C termasuk agen infeksius lain yang terkandung pada bahan yang diperiksa. Berkaitan dengan hal tersebut berbagai institusi yang bekerja dengan bahan berisi agen infeksius harus memastikan keamanan bagi semua, bahwa program keselamatannya berjalan efektif, kemampuan staf terjamin, kemampuan fasilitas, peralatan dan manajemen dapat memenuhi kebutuhan untuk keamanan dan keselamatan terhadap bahaya agen infeksius. Staf laboratorium yang menangani mikroba patogen atau infeksius harus mengerti kondisi bagaimana cara yang aman memanipulasi patogen tersebut. Aplikasi pengetahuan dan penggunaan peralatan yang sesuai dan tepat dapat mencegah potensi paparan terhadap staf, laboratorium dan lingkungan terhadap agen infeksius atau bahan biologik berbahaya. Pengendalian infeksi di laboratorium dilaksanakan dengan menerapkan kewaspadaan standar di laboratorium dengan berbagai tindakan untuk mencegah terjadinya infeksi pada petugas laboratorium, pasien, pengunjung sarana kesehatan dan penduduk sekitar sarana kesehatan atau laboratorium akibat semua kegiatan dalam sarana kesehatan atau laboratorium tersebut. Penerapan kewaspadaan standar dalam hal pengendalian infeksi di laboratorium dilaksanakan tanpa memandang status pasien apakah menderita penyakit menular atau tidak dan juga kepatuhan dalam mengikuti panduan biosafety dapat menurunkan risiko terpapar dan infeksi yang didapatkan di laboratorium. Secara detail mengenai keselamatan dan keamanan kerja di laboratorium mengacu kepada Keputusan Menteri Kesehatan Nomor 835 Tahun 2009 tentang Pedoman Keselamatan dan Keamanan Mikrobiologik dan Biomedik. 6.1 MANAJEMEN KEAMANAN KERJA LABORATORIUM Untuk memenuhi standar keamanan dan keselamatan di laboratorium, beberapa hal berikut ini perlu diperhatikan oleh manajemen di rumah sakit, puskesmas, maupun laboratorium mandiri. 36 6.1.1 VAKSINASI BAGI PETUGAS LABORATORIUM Vaksin terhadap Hepatitis B telah tersedia dan sangat direkomendasikan bagi staf laboratorium untuk dilakukan wajib vaksinasi. Vaksin terhadap Hepatitis B dapat juga memproteksi terhadap Hepatitis D yang penularannya melalui cara yang sama. Vaksin Hepatitis C belum tersedia sampai saat ini untuk penggunaan di manusia. 6.1.2 PENYEDIAAN SARANA PRASARANA DAN ALAT LABORATORIUM YANG STANDAR a. Rancangan Konstruksi dan Tata Ruang Laboratorium Rancangan dan konstruksi fasilitas laboratorium harus ditujukan untuk perlindungan terhadap staf/ petugas laboratorium, orang diluar laboratorium, hewan dan komunitas sekitar dari agen infeksius yang dapat tidak sengaja terlepas dari laboratorium. Laboratorium diagnostik atau laboratorium pemeriksa Hepatitis bekerja menggunakan bahan yang berasal dari cairan tubuh termasuk darah. Rekomendasi untuk laboratorium yang menggunakan bahan cairan tubuh atau jaringan yang diketahui terinfeksi atau berpotensi infeksius adalah laboratorium dengan fasilitas, peralatan dan praktek biosafety level 2 (BSL-2). Untuk Puskesmas mengacu pada Permenkes Nomor 37 Tahun 2012 Tentang Penyelenggaraan Laboratorium Puskesmas. b. Peralatan Manajemen rumah sakit atau laboratorium dengan fasilitas BSL-2 harus melengkapi peralatan keselamatan, seperti Biosafety Cabinets (BSCs) atau peralatan lain yang membatasi sebaran secara fisik atau centrifuge yang dilengkapi alat proteksi. Akses ke laboratorium dibatasi selama pelaksanaan aktivitas tersebut. c. Alat Pelindung Diri Alat pelindung diri, seperti perisai cipratan, pelindung wajah, jas lab, masker dan sarung tangan harus digunakan sebagaimana mestinya. 6.1.3 MANAJEMEN PENGELOLAAN LIMBAH Semua limbah padat yang tercemar darah, cairan tubuh, spesimen laboratorium, jaringan tubuh harus ditempatkan dalam kantong berwarna kuning yang kedap air, tidak bocor dan berlambang biohazard. 37 - - Pemusnahan limbah padat dilakukan dengan insinerasi. Apabila tidak memiliki incinerator, limbah padat sebaiknya dikelola oleh pihak ketiga. Limbah cair harus dibuang melalui IPAL (Instalasi Pengelolan Air Limbah). 6.1.4 PEMBENTUKAN TIM K3 LABORATORIUM Masing-masing laboratorium di rumah sakit dan fasyankes wajib memiliki tim K3 laboratorium, yang bertanggung jawab terhadap keamanan dan keselamatan petugas laboratorium dan lingkungan sekitar laboratorium. 6.2 TINDAKAN KEWASPADAAN BAGI PETUGAS LABORATORIUM Kewaspadaan standar merupakan upaya pengendalian infeksi yang harus diterapkan dalam pelayanan kesehatan kepada semua pasien, setiap waktu, untuk mengurangi risiko infeksi yang ditularkan melalui darah. 6.2.1 PENERAPAN KEWASPADAAN STANDAR Kewaspadaan standar meliputi hal-hal sebagai berikut: a. Cuci tangan dengan sabun dan air mengalir sebelum dan sesudah melakukan tindakan atau perawatan. b. Penggunaan alat pelindung yang sesuai untuk setiap tindakan seperti misalnya: sarung tangan, jas laboratorium, celemek, masker, kaca mata pelindung untuk setiap kontak langsung dengan darah atau cairan tubuh lain. c. Pengelolaan dan pembuangan alat tajam dengan hati-hati. d. Pengelolaan limbah yang tercemar oleh darah atau cairan tubuh dengan aman. e. Pengelolaan alat kesehatan bekas pakai dengan melakukan dekontaminasi, disinfeksi dan sterilisasi dengan benar. 6.2.2 PENGENDALIAN INFEKSI Sterilisasi dan disinfeksi merupakan tindakan untuk mencegah terjadinya infeksi virus Hepatitis. Cara sterilisasi yang dikomendasikan adalah sterilisasi uap bertekanan (otoklaf atau pressure cooker), atau panas kering seperti oven. Disinfeksi umumnya menggunakan alkohol 70% atau hipoklorit 5% mampu menginaktifasi virus Hepatitis. 38 6.2.3 PENATALAKSANAAN PASKA PAJANAN Kecelakaan kerja yang dapat terjadi di laboratorium pemeriksa Hepatitis yaitu: a. Kecelakaan tertusuk benda tajam. b. Pajanan darah/ bahan infeksius lain. 6.2.3.1 TINDAKAN PASKA PAJANAN Segera setelah terjadi pajanan darah/ cairan tubuh dan alat tajam tercemar, langkah tindakan yang harus dilakukan adalah: a. Luka tusukan jarum suntik atau luka iris segera dicuci dengan sabun atau larutan disinfektan ringan seperti chlorhexidine gluconate dan air mengalir. Jika tidak ada air yang mengalir, bersihkan daerah luka dengan larutan pembersih tangan. Jangan menggunakan larutan disinfektan yang sangat kuat, seperti iodium, untuk membersihkan daerah luka karena dapat mengiritasi dan memperburuk daerah luka. b. Percikan pada mukosa hidung, mulut atau kulit segera dibilas dengan guyuran air. Bila mengenai mulut, segera buang cairan di mulut (ludahkan), kumur dengan air atau larutan garam fisiologis dan buang (lakukan beberapa kali). Jangan menggunakan sabun atau larutan disinfektan yang sangat kuat. c. Mata diirigasi dengan air bersih, larutan garam fisiologis atau air steril. Jika menggunakan lensa kontak harus dilepaskan ketika membasuh mata. Jangan menggunakan sabun atau disinfektan di mata. d. Jari yang tertusuk tidak boleh dihisap dengan mulut seperti kebanyakan tindakan refleks untuk menghisap darah. Jangan memijat, memencet atau menggosok daerah luka. e. Dilakukan pemeriksaan untuk petugas yang terpapar: - Anti HBs. - Cek data dasar anti-HCV, kemudian cek RNA VHC dalam waktu 7-10 hari atau cek anti-HCV dalam waktu 2-6 bulan setelah terpajan. 39 6.2.3.2 PROFILAKSIS PASKA PAJANAN a. Hepatitis B: kurang dari 24 jam harus diberikan HBIg dan vaksinasi. b. Hepatitis C: tidak diberikan profilaksis. Tabel 2. Status Infeksi Sumber Pajanan dan Vaksin Petugas Kesehatan Status infeksi Sumber Pajanan Vaksinasi dan respon antibodi dari Petugas Kesehatan± Belum divaksinasi HBsAg positif HBsAg negatif Tidak tahu sarana pemeriksaan (-) 1 dos HBIG + seri vaksinasi hepatitis B Seri vaksinasi hepatitis B Seri vaksinasi hepatitis B Sumber pajanan berisiko tinggi obati seperti pada HBsAg positif Diketahui sbg responder Tidak perlu PPP Tidak perlu PPP Tidak perlu PPP Diketahui sbg nonresponder 1 dosis HBIG + ulangan seri vaksinasi hepatitis B atau 2 dosis HBIG Tidak perlu PPP Sumber pajanan berisiko tinggi obati seperti pada HBsAg positif Tidak diketahui status respon antibodinya Anti-HBs terpajan cukup - tidak perlu PPP tidak cukup - 1 dosis HBIG + vaksin boster Tidak perlu PPP Anti-HBs terpajan cukup - tidak perlu PPP tidak cukup - 1 dosis HBIG + vaksin boster Pernah divaksinasi 6.2.3.3 LAPORAN PAJANAN a. Setelah melakukan pertolongan pertama maka orang yang terpajan harus segera melaporkan kepada Tim Keselamatan dan Kesehatan Kerja (K3) dan diperlakukan sebagai keadaan darurat. 40 b. Laporan sangat diperlukan karena pemberian profilaksis paska pajanan harus segera dimulai secepat mungkin dalam waktu 24 jam. c. Memulai pengobatan setelah 72 jam tidak dianjurkan karena semakin lama tertunda semakin kecil arti profilaksis paska pajanan. d. Alur pelaporan pajanan mengacu pada peraturan/ prosedur yang berlaku di masing-masing sarana kesehatan. e. Prosedur yang dianjurkan adalah segera melaporkan pajanan kepada penanggung jawab ruangan dan sebaiknya segera mengisi formulir pelaporan untuk diserahkan pada pimpinan sarana kesehatan secara langsung atau melalui Tim K3 untuk memproses kejadian/ pajanan (lampiran 3). 41 BAB VII PEMANTAPAN MUTU Pemantapan mutu dilakukan secara terus-menerus untuk memantau kondisi reagen, alat yang digunakan dan kinerja petugas. Pemantapan mutu harus dilakukan secara internal dan eksternal. Pemantapan mutu internal dilakukan oleh laboratorium pemeriksa menggunakan bahan kontrol komersial atau sampel yang sudah diketahui hasil sebelumnya dan harus dilakukan sebelum melakukan pemeriksaan sampel. Pemantapan mutu eksternal dilakukan secara berkala oleh Kementerian Kesehatan secara Nasional ataupun regional. 7.1 PEMANTAPAN MUTU INTERNAL Pemantapan mutu internal (PMI) adalah kegiatan yang dilaksanakan oleh masing-masing laboratorium secara terus menerus agar tidak terjadi atau mengurangi kejadian error/ penyimpangan sehingga diperoleh hasil pemeriksaan yang tepat. Tujuan: a. Pemantapan dan penyempurnaan metode pemeriksaan dengan mempertimbangkan aspek analitik dan klinis. b. Mempertinggi kesiagaan tenaga, sehingga pengeluaran hasil yang salah tidak terjadi dan perbaikan penyimpangan dapat dilakukan segera. c. Memastikan bahwa semua proses mulai dari persiapan pasien, pengambilan, pengiriman, penyimpanan dan pengolahan spesimen sampai dengan pencatatan dan pelaporan telah dilakukan dengan benar. d. Mendeteksi penyimpangan dan mengetahui sumbernya serta melakukan perbaikan pemeriksaan. e. Membantu perbaikan pelayanan kepada pelanggan (customer). Kegiatan PMI meliputi penyediaan SPO dan beberapa kegiatan yang terdiri atas: tahap pra-analitik, analitik dan pasca-analitik. Beberapa kegiatan pemantapan mutu internal yang dibahas: a. Penyediaan pedoman SPO dan IK SPO yang harus dimiliki laboratorium: - SPO persiapan dan pengambilan spesimen - SPO pengelolaan spesimen - SPO teknis pemeriksaan - SPO pengelolaan limbah - SPO penyimpanan alat dan bahan habis pakai - SPO pemeliharaan alat dan bahan habis pakai 42 - SPO pemeliharaan sarana dan prasarana laboratorium - SPO pencatatan dan pelaporan b. Persiapan pasien Sebelum spesimen diambil, pasien harus dipersiapkan terlebih dahulu dengan baik. c. Penerimaan spesimen Petugas penerimaan spesimen harus memeriksa kesesuaian antara spesimen yang diterima dengan formulir permintaan pemeriksaan dan mencatat kondisi fisik spesimen tersebut pada saat. Spesimen yang tidak sesuai dan memenuhi persyaratan seperti hemolisis atau lipemik hendaknya ditolak. Dalam keadaan spesimen tidak dapat ditolak (via pos, ekspedisi), maka perlu dicatat dalam buku penerimaan spesimen dan formulir hasil pemeriksaan. d. Pengambilan dan pengolahan spesimen Spesimen harus diambil secara benar dengan memperhatikan volume, cara, peralatan, wadah spesimen, pengawet/antikoagulan, sesuai dengan persyaratan pengambilan spesimen. e. Pengiriman spesimen Jika laboratorium tidak mampu melakukan pemeriksaan, maka sebaiknya spesimen dikirim ke laboratorium lain atau rujukan dalam bentuk yang lebih stabil (serum) dengan menggunakan cool box diberi ice pack dengan suhu (4-8)o C. f. Penyimpanan spesimen Beberapa spesimen yang tidak langsung diperiksa dapat disimpan dengan memperhatikan jenis pemeriksaan yang akan diperiksa dan simpan di tempat yang sesuai untuk jenis spesimen yang akan diperiksa (di suhu kamar atau dilemari pendingin dengan suhu (4-8)o C). g. Kalibrasi peralatan Salah satu faktor yang dapat mempengaruhi hasil pemeriksaan laboratorium adalah peralatan laboratorium, oleh karena itu alat perlu dipelihara dan dikalibrasi secara berkala. h. Pencatatan Suhu Pencatatan suhu dilakukan secara rutin sebagai bagian dari pemeliharaan peralatan laboratorium karena suhu yang tidak sesuai dapat mempengaruhi hasil pemeriksaan. i. Pemantauan Reagen Pemantauan reagen dapat dilakukan dengan pemeriksaan bahan kontrol assayed (komersial) yang telah diketahui hasilnya dengan menggunakan reagen tersebut. Selain pemantauan reagen, hal-hal lain yang perlu diperhatikan adalah: Sudah terdaftar di Kemenkes 43 j. 7.2 Etiket/label wadah Batas kadaluwarsa Keadaan fisik Uji Ketepatan dan Ketelitian Uji ketepatan dan ketelitian dilakukan untuk menjaga mutu hasil pemeriksaan, sehingga mempunyai tingkat akurasi dan presisi yang dapat dipertanggungjawabkan. PEMANTAPAN MUTU EKSTERNAL Pemantapan Mutu External (PME) adalah suatu proses yang berkala dan berkesinambungan yang dilakukan oleh laboratorium yang lebih tinggi jenjangnya atau laboratorium rujukan Nasional yang ditunjuk oleh Kemenkes dalam jejaring untuk memantau kinerja laboratorium pemeriksa Hepatitis. Pemantapan mutu eksternal Hepatitis dilaksanakan dengan: 1. Tes panel (proficiency testing) yaitu pemeriksaan bahan kontrol oleh petugas laboratorium pemeriksa yang dikirimkan dari laboratorium penyelenggara tes panel. 2. Supervisi/ bimbingan teknis yaitu pemantauan langsung dan bimbingan teknis di laboratorium oleh team supervisi dari laboratorium rujukan. Pelaksanaan tes panel dilaksanakan dengan siklus/periode tertentu setiap tahun oleh pihak penyelenggara yang ditunjuk oleh Kementerian Kesehatan. Analisa hasil harus dilakukan oleh laboratorium penyelenggara dan segera mengirimkan umpan balik setelah hasil dianalisa ke laboratorium peserta. Umpan balik dapat digunakan: 1. Laboratorium peserta dapat melihat hasil yang diterima dan merencanakan upaya perbaikkan jika masih ada kesalahan yang mungkin dilakukan. 2. Penyelenggara dapat melihat wilayah mana saja yang memerlukan bimbingan teknis atau supervisi. Penyelenggara wajib melaporkan pelaksanaan tes panel ke unit di Kementerian Kesehatan yang mempunyai tupoksi pembinaan laboratorium. 44 Pembinaan laboratorium untuk pemeriksaan Hepatitis dilakukan secara berjenjang yang dibantu Tim Pemantapan Mutu sebagai berikut: 1. Tim pemantapan mutu laboratorium Nasional Koordinator Tim Pemantapan Mutu laboratorium nasional adalah Direktorat Bina Pelayanan Penunjang Medik dan Sarana Kesehatan, Ditjen Bina Upaya Kesehatan, Kementerian Kesehatan RI berkoordinasi dengan fokal poin terkait pemeriksaan Hepatitis dari masing-masing laboratorium rujukan Regional dan Nasional serta organisasi profesi terkait. Tim Pemantapan Mutu laboratorium Pusat ditetapkan oleh Kementerian Kesehatan. 2. Tim pemantapan mutu laboratorium Regional Hepatitis Tim Pelaksana PME regional dilakukan oleh BB/BLK yang ditunjuk oleh Kemenkes. Beberapa pokok kegiatan yang dilaksanakan oleh Tim Pemantapan Mutu meliputi perencanaan, pelaksanaan, monitoring dan evaluasi terkait kegiatan PME, supervisi/ bimbingan teknis, antara lain: 1. Menyusun perencanaan, pelaksanaan dan evaluasi Pemantapan Mutu Eksternal, meliputi: - Penentuan Administrasi Dan Cara Pengiriman Bahan Uji - Penentuan Bahan Uji Panel Yang Dipakai - Penentuan Metode Pemeriksaan - Penentuan Jumlah Siklus Dan Waktu Penyelenggaraan - Penentuan Jenis Parameter - Penentuan Nilai Acuan - Penentuan Metode Evaluasi 2. Menyusun dan melakukan sosialisasi pedoman jejaring dan pemantapan mutu laboratorium Hepatitis. 3. Melakukan koordinasi dengan jejaring Laboratorium pemeriksa Hepatitis di wilayahnya. 4. Melakukan monitoring, memberikan rekomendasi bimbingan teknis dan evaluasi terhadap hasil pemantapan mutu laboratorium Hepatitis. 5. Melakukan evaluasi dan penilaian terhadap mutu reagen dan alat yang digunakan oleh laboratorium peserta PME. 45 LAB PENYELENGGARA/ LAB RUJUKAN PERSIAPAN BAHAN PANEL PENGIRIMAN BAHAN PANEL LABORATORIUM PESERTA PEMERIKSAAN ANALISA HASIL MELAPORKAN HASIL PEMERIKSAAN MENGIRIMKAN UMPAN BALIK MONITORING DAN EVALUASI Gambar 6. Proses Penyelenggaraan Tes Panel 7.3 PENINGKATAN MUTU Peningkatan mutu adalah proses yang terus menerus dilakukan oleh laboratorium dengan cara menganalisis setiap aspek dalam pemeriksaan laboratorium dan sebagai tindak lanjut kegiatan PMI dan PME untuk meningkatkan kinerja laboratorium. Komponen kunci dalam proses ini meliputi identifikasi masalah, yang dilanjutkan dengan menyusun rencana tindak lanjut untuk perbaikan, menetapkan perubahan prosedur atau membuat prosedur baru, dan menjadwalkan evaluasi berkala dalam pemantauan yang dilakukan secara terus menerus. 46 BAB VIII PENUTUP Pedoman Pelayanan Laboratorium Pemeriksa Hepatitis ini dapat dipakai sebagai pedoman atau petunjuk bagai para petugas laboratorium sehingga dapat mengetahui dengan jelas tugas dan fungsi laboratorium kesehatan diberbagai jenjang pelayanan laboratorium serta dapat meningkatkan kemampuan pemeriksaan Hepatitis. Disamping itu tujuan pedoman ini diharapkan dapat terwujudnya keseragaman pemeriksaan Hepatitis serta mutu hasil pemeriksaannya, sesuai jenjang pelayanan laboratorium dan metode yang dipakai dengan tidak menyampingkan Pedoman Nasional lain yang telah ada. Pedoman ini akan ditinjau kembali apabila diperlukan, sesuai dengan perkembangan ilmu pengetahun dan teknologi untuk pemeriksaan Hepatitis. 47 DAFTAR PUSTAKA Departemen Kesehatan RI Direktorat Jenderal Pengendalian Penyakit dan Penyehatan Lingkungan Tahun 2012, Buku Pedoman Pengendalian Hepatitis Virus. Kementerian Kesehatan RI. Badan Litbangkes. Laporan Riset Dasar Kesehatan Tahun 2013. Peraturan Menteri Kesehatan RI No. 37 Tahun 2012 Tentang Penyelenggaraan Laboratorium Pusat Kesehatan Masyarakat. Keputusan Menteri Kesehatan Nomor 241/Menkes/SK/IV/2006 tentang Standar Pelayanan Laboratorium Kesehatan Pemeriksa HIV dan Infeksi Oportunistik. Kieleczawa J, Mazaika E. Optimization of Protocol for Sequencing of Difficult Templates. J Biomol Tech. 2010;21:97-102. Valsamakis A. Molecular Testing in the Diagnosis and Management of Chronic Hepatitis B. Clinical Microbiology Reviews. 2007;20(3):426-39. Saleem Kamili JD, Aufra C. Araujo, and Tonya M. Hayden. Laboratory Diagnostics for Hepatitis C Virus Infection. CID. 2012;55. Rino Gani IH, Ali Djumhana,Poernomo Boedi Setiawan. Konsensus Nasional Penatalaksanaan Hepatitis B. Akbar N, editor. Jakarta: Perhimpunan Peneliti Hati Indonesia; 2012. Rino A. Gani IH, Andri Sanityoso, Rinaldi A. Lesmana, Agus S. Waspodo, Lianda Siregar, Ali Djumhana, Poernomo Boedi Setiawan, Putut Bayupurnama, Juferdy Kurniawan. Konsensus Nasional Penatalaksanaan Hepatitis C di Indonesia. Sanityoso A, editor. Jakarta: Perhimpunan Peneliti Hati Indonesia; 2014. Constantine N.T, Saville R.D and Dax E.M. Retroviral Testing and Quality Assurance Essentials for Laboratory Diagnosis. National Serology Reference Laboratory, Australia a World Health Organization Collaborating Centre on HIV/AIDS. Australia. 2005: 288-298. Akbar N. Hepatitis B. In: Ali Sulaiman NK, Laurentius A.Lesmana,Sjaifoellah Noer, editor. Buku Ajar Ilmu Penyakit Hati. 1 ed. Jakarta: Jayabadi; 2007. p. 202-3. 48 Sulaiman A. Hepatitis C. In: Ali Sulaiman NK, Laurentius A.Lesmana,Sjaifoellah Noer, editor. Buku Ajar Ilmu Penyakit Hati. 1 ed. Jakarta: Jayabadi; 2007. p. 214,7-8. Centers for Disease Control and Prevention. Management of Specific Disease Hepatitis B. Communicable Disease Control. CDC2009. Soedarmono Y. Keamanan Darah Transfusi Terhadap Virus Hepatitis B di Indonesia: Kegagalan Deteksi Serologi Dan Dasar Molekulnya. Disertasi Program Pendidikan Doktor pada Program Studi Biomedik, Fakultas Kedokteran Universitas Indonesia. Jakarta. 2010. WHO Recommendation: Screening Donated Transmissible Infections. Geneva. 2010. Blood for Transfusion Kementrian Kesehatan RI. Balibangkes. Laporan Riskesdas Biomedis, 2007. Laporan tahun 2012 Pelayanan Darah oleh UTD PMI. 49 LAMPIRAN LAMPIRAN 1 Tabel 1. Ringkasan tentang petanda uji saring, metoda dan rekomendasi untuk Hepatitis B dan Hepatitis C.15 Virus Petanda Metoda Rekomendasi Komentar serologi* Hepatitis HbsAg Imunoassay: Direkomendasikan Petanda serologi yang pertama untuk infeksi HBV B EIA Jumlah HBsAg yang dproduksi dan dilepaskan CLIA kedalam sirkulasi tidak berhubungan dengan asam nukleat virus Penting untuk uji saring HBV yang efektif; uji saring HBsAg direkomendasikan sebagai standar minimum untuk keamanan darah Imunoassay: Diterapkan pada Rapid test situasi khusus: jumlah pemeriksaan kurang dari 60 pemeriksaan/minggu, di daerah terpencil atau pada keadaan darurat. Anti-HBc Imunoassay: Tidak Dipergunakan sebagai petanda tambahan di EIA direkomendasikan, beberapa negara untuk mengidentifikasi infeksi CLIA terutama di negara yang membaik saat titer HBsAg menurun di bawah dengan prevalensi titer deteksi, tapi HBV DNA mungkin masih ada 50 infeksi HBV yang tinggi. Alanin aminotransfe rase (ALT) DNA HBV Virus Hepatitis C Petanda serologi* Anti-HCV Assay biokimia Tidak direkomendasikan Teknologi amplifikasi asam nukleat Uji saring dengan NAT dilakukan untuk meningkatkan keamanan darah, namun perlu memperhatikan aspek pembiayaan dan ketersediaan logistik. Metoda Imunoassay: EIA Rekomendasi Direkomendasikan Mungkin merupakan satu-satunya petanda infeksi Assay memiliki kelemahan spesifisitas sementara assay konfirmasi yang spesifik tidak ada Titer anti-HBs harus ditetapkan untuk semua darah dengan anti-HBc reaktif untuk mengidentifikasi infeksi yang sudah teratasi Di beberapa negara ditetapkan bahwa jika darah anti-HBc nya reaktif dan titer anti-HBs nya > 100mIU/mL dapat digunakan untuk kepentingan klinis Merupakan petanda infeksi HBV yang bersirkulasi pertama kali dalam darah, namun kegunaannya dalam uji saring darah terbatas jika pemeriksaannya dilaksanakan secara individual Virus biasanya pada titer yang rendah dan masa jendela (window periode) antara deteksi HBV DNA dan HBsAg umumnya sangat pendek Komentar Saat ini merupakan petanda serologi infeksi HCV yang umum digunakan 51 CLIA Imunoassay: Rapid test Antigen HCV Imunoassay: EIA CLIA Muncul sebagai reaksi terhadap infeksi, namun periode masa jendela (window periode) dari keberadaan HCV RNA relatif panjang Uji saring antibody HCV direkomendasikan sebagai standar minimum untuk keamanan darah Dapat diterapkan pada situasi khusus: jumlah pemeriksaan kurang dari 60 pemeriksaan/minggu, di daerah terpencil atau pada keadaan darurat. Direkomendasikan Petanda serologi infeksi HCV yang pertama jika menjadi bagian Target yang berharga untuk uji saring darah donor dari assay antibodimeskipun antigen akan dinetralisasi oleh antibodi antigen Uji saring hanya terhadap antigen HCV tidak tepat oleh karena titer antigen akan menurun saat titer antibodi meningkat Antigen HCIV mungkin terdeteksi pada waktu yang bersamaan atau segera setelah RNA HCV terdeteksi Assay antigen HCV yang tersedia sangat terbatas Assay serologi HCV yang paling sensitif mengkombinasikan deteksi antigen dan antibodi. Assay ini dipertimbangkan sebagai assay yang paling efektif untuk uji saring darah donor walaupun saat ini keberadaan assay jenis ini sangat 52 RNA HCV Teknologi amplifikasi asam nukleat Uji saring dengan NAT dilakukan untuk meningkatkan keamanan darah, namun perlu memperhatikan aspek pembiayaan dan ketersediaan logistik. terbatas Merupakan petanda infeksi HCV yang bersirkulasi pertama kali dalam darah, namun masa jendela (window periode) antara deteksi RNA HCV dan antigen HCV semakin pendek Bernilainya uji saring RNA harus dikaitkan dengan pelaksanaan uji saring serologi dan insidensi infeksi pada donor Keterangan: * Petanda infeksi yang potensial sebagai target uji saring 53 LAMPIRAN 2 Formulir Kuesioner dan Informed Consent Donor Logo UTD UNIT TRANSFUSI DARAH Selamat Datang, Terima kasih atas kesediaan anda meluangkan waktu untuk menyumbangkan darah. Mohon formulir ini diisi dengan sejujurnya untuk keselamatan anda dan calon penerima darah anda. KUESIONER DONOR Beri tanda x (silang) pada jawaban anda Apakah anda : 1. Merasa sehat pada ?hari ini 2. Sedang minum antibiotik ? 3. Sedang minum obat lain untuk infeksi? Ya Tidak Diisi petugas Dalam waktu 48 Jam terakhir 4. Apakah anda sedang minum Aspirin atau obat yang mengandung aspirin Dalam waktu 1 minggu terakhir 5. Apakah anda mengalami sakit kepala dan demam bersamaan? Dalam waktu 6 minggu terakhir 6. Untuk donor wanita : apakah anda saat ini sedang hamil?Jika Ya, kehamilan keberapa?...... 54 Dalam waktu 8 minggu terakhir 7. Apakah anda mendonorkan darah, trombosit atau plasma? 8. Apakah anda menerima vaksinasi atau suntikan lainnya? 9. Apakah anda pernah kontak dengan orang yang menerima vaksinasi smallpox? Dalam waktu 16 minggu terakhir 10. Apakah anda mendonorkan 2 kantong sel darah merah melalui proses aferesis? Dalam waktu 12 bulan terakhir 11. Apakah anda pernah menerima transfusi darah? 12. Apakah anda pernah mendapat transplantasi, organ, jaringan atau sumsum tulang? 13. Apakah anda pernah cangkok tulang atau kulit? 14. Apakah anda pernah tertusuk jarum medis? 15. Apakah anda pernah berhubungan seksual dengan ODHA ? 16. Apakah anda pernah berhubungan seksual dengan WPS? 17. Apakah anda pernah berhubungan seksual dengan pengguna narkoba jarum suntik? 18. Apakah anda pernah berhubungan seksual dengan pengguna konsentrat faktor pembekuan ? 19. Donor wanita : apakah anda pernah berhubungan seksual dengan laki-laki yang biseksual ? 20. Apakah anda pernah berhubungan seksual dengan penderita hepatitis? 21. Apakah anda tinggal bersama penderita hepatitis? 22. Apakah anda memiliki tatto? 23. Apakah anda memiliki tindik telinga atau bagian tubuh lainnya? 24. Apakah anda sedang atau pernah mendapat pengobatan sifilis atau GO (kencing nanah) 25. Apakah anda pernah ditahan di penjara untuk waktu lebih dari 72 jam? 55 Dalam waktu 3 tahun 26. Apakah anda pernah berada di luar wilayah Indonesia? Tahun 1980 hingga 1996 27. Apakah anda tinggal selama 3 bulan atau lebih di Inggris? Tahun 1980 hingga sekarang 28. Apakah anda tinggal selama 5 tahun atau lebih di Eropa? 29. Apakah anda menerima transfusi darah di Inggris? Tahun 1977 hingga sekarang 30. Apakah anda menerima uang, obat atau pembayaran lainnya untuk seks? 31. Laki-laki : Apakah anda pernah berhubungan seksual dengan laki-laki, walaupun sekali? Apakah anda PERNAH 32. Mendapatkan hasil positif untuk tes HIV/AIDS? 33. Menggunakan jarum suntik untuk obat-obatan,steroid yang tidak diresepkan dokter? 34. Menggunakan konsentrat faktor pembekuan? 35. Menderita Hepatitis? 36. Menderita Malaria? 37. Menderita kanker termasuk leukimia? 38. Bermasalah dengan jantung dan paru-paru ? 39. Menderita perdarahan atau penyakit berhubungan dengan darah? 40. Apakah anda pernah berhubungan seksual dengan orang yang tinggal di Afrika? 41. Tinggal di Afrika? 56 * = Daftar negara dengan prevalensi IMLTD tinggi **= Jenis vaksinasi/imunisasi INFORMED CONSENT DONOR Yth Unit Transfusi Darah …………….. Saya telah mendapatkan dan membaca semua informasi yang diberikan serta menjawab pertanyaan dengan jujur. Saya mengerti dan bersedia menyumbangkan darah dengan volume sesuai standar yang diberlakukan dan setuju diambil contoh darahnya untuk keperluan pemeriksaan laboratorium berupa uji golongan darah, HIV, Hepatitis B , Hepatitis C, Sifilis dan infeksi lainnya yang diperlukan serta untuk kepentingan penelitian. Bila ternyata hasil pemeriksaan labotarium perlu ditindaklanjuti, maka saya setuju untuk diberi kabar tertulis. Jika komponen plasma tidak terpakai untuk transfusi, saya setuju dapat dijadikan produk plasma untuk pengobatan. Tanda Tangan Petugas Tanda Tangan Donor 57 LAMPIRAN 3 Contoh formulir pelaporan pajanan adalah sebagai berikut : Contoh Formulir Laporan Pajanan LAPORAN PAJANAN Petunjuk Pengisian Formulir dibuat 2 (dua) rangkap Diisi oleh tenaga kesehatan yang terpajan Formulir A : dan menyerahkan formulir pada Instalasi Gawat Darurat/Poliklinik dengan tembusan ke Panitia PIN Formulir B : Diisi petugas Instalasi Gawat Darurat/ Poliklinik, tindakan diserahkan pada tenaga kesehatan yang terpajan untuk diserahkan pada atasan langsung dengan tembusan ke Panitia PIN FORMULIR A Tanggal laporan : Jam : Tanggal pajanan : Jam : Tempat Kejadian : Unit Kerja terpajan : Identitas Nama : Alamat : Atasan langsung : Alamat : Route Pajanan : Tusukan jarum suntik Luka pada kulit Sumber pajanan : Darah Sputum Gigitan Mata Air Liur Mulut/ mulut ke mulut Lain-lain Feses Lain-lain (sebutkan) Bagian tubuh yang terpajan sebut secara jelas : Jelaskan urutan kejadian : Imunisasi Hepatitis B Sudah Belum Atas pelindung Dipakai Tidak dipakai Jenis Pertolongan Pertama Ada Tidak Tempat pertolongan : Tanggal : Tanda tangan yang terpajan : 58 Contoh formulir pelaporan pajanan adalah sebagai berikut : Contoh Formulir Laporan Pajanan LAPORAN PAJANAN Petunjuk Pengisian Formulir dibuat 2 (dua) rangkap Diisi oleh tenaga kesehatan yang terpajan Formulir A : dan menyerahkan formulir pada Instalasi Gawat Darurat/Poliklinik dengan tembusan ke Panitia PIN Formulir B : Diisi petugas Instalasi Gawat Darurat/ Poliklinik, tindakan diserahkan pada tenaga kesehatan yang terpajan untuk diserahkan pada atasan langsung dengan tembusan ke Panitia PIN FORMULIR B Setiap Kotak Dapat Diisi Diperiksa dokter gawat darurat Dirujuk ke dokter pribadi atau perusahaan Menolak diperiksa dokter gawat darurat Memilih mencari pertolongan dokter pribadi Setiap Kotak Dapat Diisi Panitia Infeksi Nosokomial Poliklinik Lain-lain Pasien sumber darah / bahan infeksius Nama : No Rekam Medis : Ruang Rawat : Pemantauan Pajanan (jelaskan) : Tanggal Pemberitahuan Atasan Langsung Tenaga yang Terpajan : Tanggal : Tanda tangan yang terpajan : 59 LAMPIRAN 4 CONTOH FORMULIR FORMULIR HASIL PEMERIKSAAN LABORATORIUM HEPATITIS No. Laboratorium Nama Umur Jenis Kelamin Pekerjaan Alamat rumah : : : : : : : Alamat kantor Tanggal Pemeriksaan Tanggal Hasil Hasil Pemeriksaaan: Parameter Hasil Nilai Nilai Rujukan Metode Interpretasi ................,........,......... Penanggung jawab ( ) 60 LAMPIRAN 5 CONTOH FORMULIR FORMULIR PERMINTAAN PEMERIKSAAN/RUJUKAN LABORATORIUM HEPATITIS Nomor Laboratorium Nama Umur Jenis kelamin Pekerjaan Alamat rumah : : : : : : Alamat kantor : Pengambil spesimen Tgl/jam pengambilan spesimen : : Gejala klinis : Jenis Pemeriksaaan : Metode: Rapid EIA/CLIA NAT PCR Genotyping ................,........,......... Dokter / Pengirim ( ) 61 LAMPIRAN 6 LOG BOOK PEMERIKSAAN LABORATORIUM HEPATITIS Bulan Tahun Tanggal No. Lab Nama Pasien Umur L P Pengirim Parameter Rapid Hasil Pemeriksaan EIA/CLIA PCR NAT Genotyping Pemeriksa ......., ........ Penanggung Jawab Laboratorium, (____________________) 62 LAMPIRAN 7 KINERJA HCV RAPID TEST ONKOPROBE DEVICE ADVANCE (INTEC) DEVICE SD MULTI DEVICE ONSITE DEVICE SD DEVICE RIGHT SIGN DEVICE TRIDOT DEVICE ANSWER DEVICE ANSWER STRIP POSITIF NEGATIF POSITIF NEGATIF POSITIF NEGATIF POSITIF NEGATIF POSITIF NEGATIF POSITIF NEGATIF POSITIF NEGATIF POSITIF NEGATIF POSITIF NEGATIF TOTAL RAPID TEST BAKU EMAS POSITIF NEGATIF 47 2 3 98 46 1 4 99 43 1 7 99 46 1 4 99 43 1 7 99 43 1 7 99 45 1 5 99 46 1 4 99 46 4 4 96 50 100 Sensitivitas Spesifisitas TOTAL 49 101 47 103 44 106 47 103 44 106 44 106 46 104 47 103 50 100 150 PPV NPV ONKOPROBE DEVICE 94% 98% 96% 97% ADVANCE (INTEC) DEVICE 92% 99% 98% 96% SD MULTI DEVICE 86% 99% 98% 93% ONSITE DEVICE 92% 99% 98% 96% SD DEVICE 86% 99% 98% 93% RIGHT SIGN DEVICE 86% 99% 98% 93% TRIDOT DEVICE 90% 99% 98% 95% ANSWER DEVICE 92% 99% 98% 96% ANSWER STRIP 92% 96% 92% 96% 63 KINERJA HBsAg BAKU EMAS RAPID TEST SD FAST STRIP ONCOPROBE DEVICE ADVANCE (INTEC) DEVICE HEPACARD DEVICE SD MULTI DEVICE ANSWER STRIP ONSITE DEVICE ANSWER DEVICE SD DEVICE RIGHT SIGN DEVICE ENTEBE STRIP TOTAL TOTAL POSITIF NEGATIF POSITIF 46 0 46 NEGATIF 4 100 104 POSITIF 47 0 47 NEGATIF 3 100 103 POSITIF 47 0 47 NEGATIF 3 100 103 POSITIF 47 0 47 NEGATIF 3 100 103 POSITIF 50 0 50 NEGATIF 0 100 100 POSITIF 46 0 46 NEGATIF 4 100 104 POSITIF 45 0 45 NEGATIF 5 100 105 POSITIF 46 0 46 NEGATIF 4 100 104 POSITIF 48 0 48 NEGATIF 2 100 102 POSITIF 47 0 47 NEGATIF 3 100 103 POSITIF 47 0 47 NEGATIF 3 100 103 50 100 150 64 RAPID TEST Sensitivitas Spesifisitas PPV NPV SD FAST STRIP 92% 100% 100% 96% ONCOPROBE DEVICE 94% 100% 100% 97% ADVANCE (INTEC) DEVICE 94% 100% 100% 97% HEPACARD DEVICE 94% 100% 100% 97% SD MULTI DEVICE 100% 100% 100% 100% ANSWER STRIP 92% 100% 100% 96% ONSITE DEVICE 90% 100% 100% 95% ANSWER DEVICE 92% 100% 100% 96% SD DEVICE 96% 100% 100% 98% RIGHT SIGN DEVICE 94% 100% 100% 97% ENTEBE STRIP 94% 100% 100% 97% Keterangan: Sensitivitas dari sebuah uji menggambarkan proporsi individu dengan penyakit yang diprediksi uji dengan benar (hasil uji positif). Spesifisitas menggambarkan proporsi individu tanpa penyakit yang diprediksi uji dengan benar (hasil uji negatif). Positif sebenarnya adalah individu dengan penyakit yang telah diklasifikasikan dengan benar melalui uji (hasil uji positif). Positif palsu adalah individu tanpa penyakit yang salah diklasifikasikan melalui uji (hasil uji positif). Negatif sebenarnya adalah individu tanpa penyakit yang telah diklasifikasikan dengan benar melalui uji (hasil uji negatif). Negatif palsu adalah individu dengan penyakit yang salah diklasifikasikan melalui uji (hasil uji negatif). Positive Predictive Value (PPV) adalah proporsi dari subjek dengan hasil uji positif yang benar-benar memiliki penyakit. Negative Predictive Value (NPV) adalah proporsi dari subjek dengan hasil uji negatif yang benar-benar tidak memiliki penyakit. Predictive value merupakan suatu fungsi dari sensitivitas, spesifisitas, dan prevalensi. 65