turunan asam karboksilat dan reaksi substitusi asil
advertisement
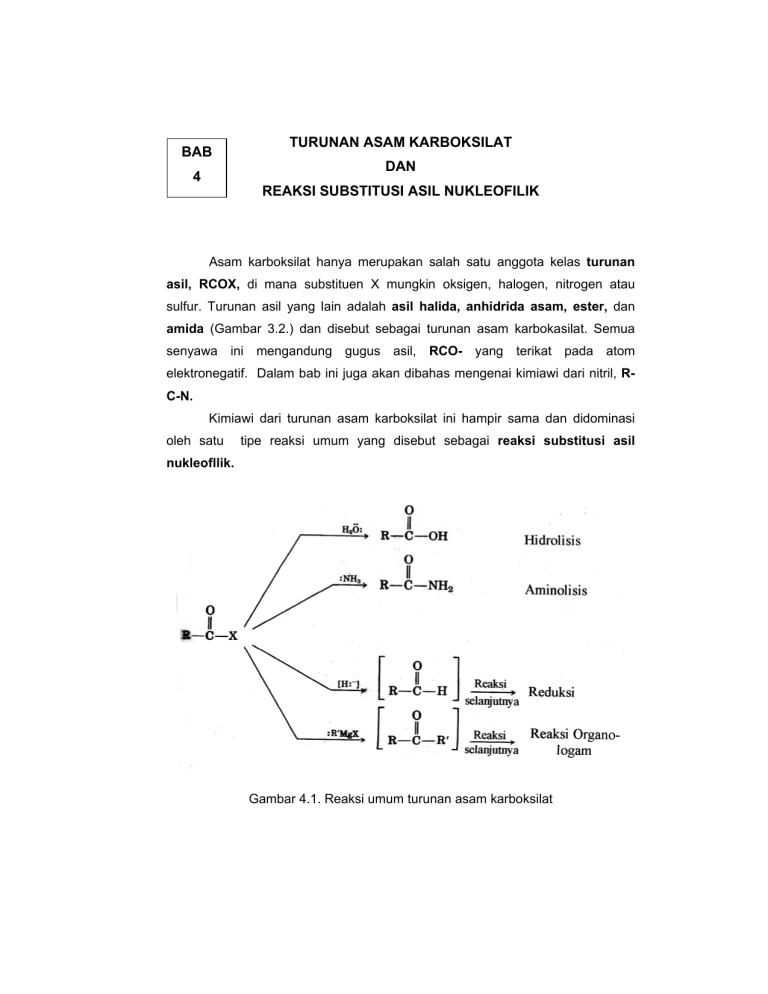
TURUNAN ASAM KARBOKSILAT BAB DAN 4 REAKSI SUBSTITUSI ASIL NUKLEOFILIK Asam karboksilat hanya merupakan salah satu anggota kelas turunan asil, RCOX, di mana substituen X mungkin oksigen, halogen, nitrogen atau sulfur. Turunan asil yang lain adalah asil halida, anhidrida asam, ester, dan amida (Gambar 3.2.) dan disebut sebagai turunan asam karbokasilat. Semua senyawa ini mengandung gugus asil, RCO- yang terikat pada atom elektronegatif. Dalam bab ini juga akan dibahas mengenai kimiawi dari nitril, RC-N. Kimiawi dari turunan asam karboksilat ini hampir sama dan didominasi oleh satu tipe reaksi umum yang disebut sebagai reaksi substitusi asil nukleofllik. Gambar 4.1. Reaksi umum turunan asam karboksilat 4.1. Reaksi substitusi nukleofilik asil. Pada pembahasan mengenai kimiawi gugus karbonil di bab 1, telah jabarkan bahwa adisi nukleofilik pada gugus karbonil (C=O) yang polar adalah merupakan ciri-ciri umum reaksi gugus karbonil dan merupakan tahap pertama dalam dua dari empat tipe reaksi karbonil yang utama. Telah dibahas juga dalam bab 1 bahwa asam karboksilat dan turunannya mempunyai suatu gugus asil yang terikat pada suatu 'leaving group' atau gugus pergi yang potensial (gugus yang dapat pergi sebagai anion yang stabil). Bila suatu nukleofil ditambahkan pada turunan asam karboksilat, yang mula-mula terbentuk adalah suatu intermediet tetrahedral. Muatan negatif pada oksigen dalam intermediet tetrahedral ini kemudian dengan cepat dapat melepaskan ‘living group’ yang terikat pada karbon karbonil menghasilkan senyawa karbonil yang baru (asam karboksilat atau turunannya yang lain). Reaksi nettonya adalah substitusi asil nukleofilik. Mekanisme umum untuk substitusi asil nukleofilik pada turunan asam karboksilat dapat dilihat pada gambar 4.2. Gambar 4.3. Mekanisme umum substitusi asil nukleofilik 4.2. Stabilitas relatif dari turunan asam karboksilat Reaksi substitusi asil nukleofilik terjadi dalam dua tahap, yaitu adisi nukleofilik dan eliminasi 'leaving group'. Kedua tahap tersebut dapat mempengaruhi kelajuan reaksi secara keseluruhan. Meskipun demikian, secara tahap pertama adalah merupakan tahap penentu laju, dan baik efek sterik maupun elektronik merupakan factor yang penting dalam menentukan reaktivitas. Secara sterik, dalam satu seri turunan asam karboksilat yang sama, maka gugus karbonil yang lebih terhalangi akan diserang lebih lambat disbanding gugus yang sterik tak terhalangi. Secara elektronik, turunan asam yang lebih polar diserang lebih cepat dibanding ang kurang polar. Lebih stabil Kurang reaktif K A. ASIL HALIDA A.1. Tata nama Asil halide diberi nama dengan menyebutkan gugus asilnya, dan kemudian kan halidanya. A.2. Pembuatan asil halida Asil halida dapat dibuat dari reaksi antara asam karboksilat dengan tionil klorida (SOCl2), Fosfor triklorida (PCl3), oksalil klorida (ClCOCOCl). Sebagai Contoh: Reaksi ini terjadi melalui substitusi asil nukleofilik, di mana asam karboksilat diubah menjadi suatu turunan yang reaktif, yang mana kemudian diserang. A.3. Reaksi-reaksi asil halida Asil halida merupakan turunan asam karboksilat yang paling reaktif dan menjalani reaksi-reaksi yang sangat berguna (Gambar 4.4.). Sebagian besar reaksi-reaksi asil halida terjadi melalui substitusi asil nukleofilik. A.3.1. Hidrolisis Asil halida bereaksi dengan air menghasilkan asam karboksilat. Reaksi hidrolisis ini merupakan proses substitusi asil nukleofilik dan diawali oleh serangan air pada gugus karbonil asil halida. Intermediet tetrahedral yang terbentuk akan mengalami eliminasi ion klorida dan kehilangan satu proton untuk menghasilkan produk asam karboksilat. A.3.2. Alkoholisis Reaksi antara asil halide dan alcohol adalah analog reaksi asil halide dan air. Reaksi ini merupakan metode yang sangat baik untuk pembuatan ester. A.3.3. Aminolisis Asil halida bereaksi cepat dengan ammonia dan amina menghasilkan amida. Karena HCl dibebaskan selama reaksi, 2 ekivalen amina harus digunakan; 1 ekivalen bereaksi dengan asil halida, dan satu ekivalen bereaksi dengan HCl membentuk garam ammonium halida. Meskipun demikian, bila aminanya berharga, maka dapat digunakan basa yang tidak mahal untuk menangkap HCl, misalnya NaOH (reaksi Schotten-Baumann). A.3.4. Reduksi Asil halida direduksi oleh litium aluminium hidrida menghasilkan alkohol primer. Reaksi terjadi melalui mekanisme substitusi asil nukleofilik yang khas di mana hidrida ion (H:-) mula-mula menyerang gugus karbonil dan ion klorida kemudian dilepaskan. Subtitusi ini menghasilkan suatu intermediet aldehid, yang dengan cepat direduksi oleh LiAlH4 menghasilkan alkohol primer. Intermediet aldehid dapat diisolasi jika digunakan reagen hidrida yang kurang kuat, misalnya Litium tri-tert-butoksialuminium hidrida, Li+ - AlH[O-C(CH3)3]3. Alternatif yang lain, reduksi Rosenmund alkil halida di bawah kondisi hidrogenasi katalitik dapat digunakan, tetapi melalui mekanisme yang berbeda. A.3.5. Reaksi dengan organologam Reagen Grignard bereaksi dengan asil halida menghasilkan alkohol tersier di mana dua substituennya adalah sama. Mekanisme reaksi ini mirip dengan reduksi menggunakan LiAlH4. Reagen Grignard yang pertama akan menyerang asil halida. Lepasnya ion klorida kemudian akan menghasilkan intermediet keton, yang bereaksi dengan reagen Grignard yang kedua menghasilkan alkohol tersier. Intermediet keton biasanya tidak dapat diisolasi dalam reaksi Grignard, karena adisi reagen Grignard yang kedua terjadi sangat cepat. Meskipun demikian, keton dapat diisolasi dari reaksi bila digunakan reagen + diorganotembaga, R^Cuf Li , tapi reagen ini hanya bereaksi dengan asil halida saja. Ester dan amida tidak bereaksi dengan reagen ini. B. ANHIDRIDA ASAM B.1. Tata nama Anhidrida simetris dari asam monokarboksilat rantai lurus dan anhidrida siklik dari asam dikarboksilat diberi nama dengan mengganti kata asam dengan hidrida. Jika anhidrida diturunkan dari asam monokarboksilat yang tersubstitusi, penamaannya dengan menambahkan awalan bis- pada nama asamnya. B.2. Pembuatan anhidrida asam Metode yang paling umum untuk membuat anhidrida asam adalah melalui aksi substitusi nukleofilik asil antara suatu asil halida dan garam karboksilat. Baik anhidrida simetris dan tak simetris dapat dibuat dengan cara ini dengan ademen yang tinmggi. B.3. Reaksi-reaksi anhidrida Kimiawi dari anhidrida asam hampir sama dengan asil halida. Anhidrida asam bereaksi lebih lambat dari pada asil halida, tetapi macam reaksi yang dijalani adalah sama. Jadi, anhidrida asam bereaksi dengan air membentuk asam, dengan alkohol membentuk ester, dengan amina membentuk amida, dan direduksi oleh LiAiH4 sebagai berikut: C. ESTER C.1. Tata nama Nama sistematik ester diturunkan dengan pertama-tama menyebut nama gugus alkil dari alkohol, kemudian menyebutkan asam karboksilatnya. C.2. Pembuatan ester C.2.1. Dari reaksi SN2 antara garam karboksilat dengan alkil halide primer C.2.2. Esterifikasi Fishcher antara asam karboksilat dengan alcohol dengan bobot molekul rendah dengan adanya katalis asam mineral. Reaksi esterifikasi Fischer merupakan contoh yang paling dikenal dari reaksi substitusi asil nukleofilik yang dijalankan dalam suasana asam. Protonasi oksigen karbonil yang bersifat basa mengaktivasi asam karboksilat terhadap serangan nukleofilik oleh alkohol, dan kehilangan air sesudah itu akan menghasilkan produk ester. Hasil nettonya adalah substitusi -OH oleh -OR1. Semua step adalah reversibel. Mekanisme esterifikasi Fisher ini ditunjukkan dalam Gambar 4.4. Protonasi oksigen karbonil mengAktivasi gugus karbonil ………….. ……terhadap adisi nukleofilik oleh alcohol, menghasilkan intermediet tetrahedral Transfer proton dari satu iksigen ke yang Lainnya menghasilkan intermediet Tetrahedral kedua dan mengubah Hidroksil menjadi ‘leaving group’ yang baik Hilangnya air menghasilkan eter yang terprotonasi Lepasnya proton menghasilkan katalis Asam, dan memberikan produk ester bebas Gambar 4.4. Mekanisme esterifikasi Fischer C.2.3. Metil ester dapat dibuat dari reaksi antara asam karboksilat dan diazometan, CH2N2. Proses ini tidak melibatkan reaksi substitusi asil nukleofilik, karena yang terputus adalah ikatan -COO-H dari asam karboksilat. C.3. Reaksi-reaksi terhadap ester Ester menunjukkan reaksi-reaksi yang sama dengan turunan asam yang lain, tetapi mereka kurang reaktif terhadap nukleofil dari pada asil halida dan anhidra asam. Bagan berikut ini menunjukkan reaksi umum dari ester. Semua reaksi tersebut dapat berlaku baik pada asiklik ester atau siklik ester (lakton). C.3.1. Hidrolisis Ester terhidrolisis baik dalam suasana basa atau asam menghasilkan fragmen asam karboksilat dan alkohol. Reaksi hidrolisis ester ini terjadi melalui mekanisme substitusi asil nukleofilik. Hidrolisis ester dalam alkali berikut ini disebut saponifikasi (sapo = sabun). Hidrolisis ester dalam suasana asam adaiah merupakan kebalikan dari reaksi esterifikasi Fischer. Ester mula-mula diaktivasi terhadap serangan nukleofilik melalui protonasi atom oksigen karbonil. Serangan nukleofilik oleh air, diikuti oleh transfer proton dan eliminasi alkohol akan menghasilkan asam karboksilat. C.3.2. Aminolisis Amonia bereaksi dengan ester melalui mekanisme substitusi asil nukleofilik untuk menghasilkan amida. C.3.3. Reduksi Reaksi antara ester dan litium aluminium hidrida adalah merupakan metode yang bagus sekali untuk membuat alkohol primer. Mekanisme hidrolisis ester ini hampir sama dengan reduksi asil halida (lihat A.3.4.). Ion hidrida mula-rnula akan menyerang gugus karbonil, diikuti oleh eliminasi ion alkoksida rnenghasilkan intermediet aldehida. Adisi ion hidrida selanjutnya pada aldehida akan menghasilkan alkohol primer. Intermediet aldehida dapat diisolasi jika digunakan DIBAH (diisobutilaluminium hidrida) sebagai reduktornya. Satu ekivalen reagen hidrida harus digunakan dan reaksi harus dilakukan pada -78°C. C.3.4. Reaksi dengan reagen organologam Ester dan lakton bereaksi dengan 2 ekivalen reagen Grignard atau organolitium menghasilkan alcohol tersier. D. A M I D A D.1. Tata nama Ester dengan gugus –NH2 diberi nama dengan mengganti asam –at atau asam –oat dengan –amida, atau dengan mengganti asam –karboksilat dengan karboksamida. Jika atom nitrogen tersubstitusi, senyawa tersebut diberi nama dengan enyebutkan gugus substituen tersebut dan kemudian menyebutkan nama isaraya. Perlu dicatat bahwa di depan nama substituen diberi hurufW- atau N,Nimk menunjukkan bahwa gugus tersebut tenkat pada atom nitrogen. D.2. Pembuatan amida Amida biasanya dibuat dari reaksi antara asil halida dengan amonia serta mnrsa mono- dan disubstitusi sebagai berikut : D.3. Reaksi-reaksi amida D.3.1. Hidrolisis Amida kurang reaktif dibanding asil halida, anhidrida asam, maupun ester. Amida dapat dihidrolisis dengan merefluksnya baik dalam larutan asam atau basa. Kondisi yang dibutuhkan lebih keras dari pada kondisi yang diperlukan untuk menghidrolisis asil halida atau ester, tetapi mekanismenya mirip. Hidrolisis amida dalam suasana basa menghasilkan amina dan ion karboksilat sebagai produknya. Ion hidroksida akan menyerang gugus karbonil, diikuti oleh eliminasi ion amida (- :NH2). Reaksi hidrolisis dalam suasana asam terjadi melalui adisi nukleoGlik air pada amida yang terprotonasi. D.3.2. Reduksi Seperti turunan asam karboksilat lain, amida dapat direduksi oleh Litium aluminium hidrida menghasilkan suatu amina dari pada suatu alcohol. Efek netto dari reaksi reduksi amida ini adalah perubahan gugus karbonil amida menjadi gugus metilena (C=O J CH2). Reaksi semacam ini adalah spesifik untuk amida dan tidak terjadi pada turunan asam karboksilat lain. Reaksi ini diawali oleh adisi nukleofilik ion hidrida pada gugus karbonil amida, diikuti oleh pengeluaran atom oksigen sebagai anion aluminat. Intermediet imina yang terbentuk kemudian direduksi lebih lanjut oleh LiAlH4 menghasilkan amina. Perlu diperhatikan bahwa mekanisme reduksi ini hampir sama dengan reaksi antara keton atau aldehida dengan suatu amina menghasilkan imina (C=O J C=NR). Dalam kedua kasus tersebut, atom oksigen gugus karbonil dihilangkan dan ikatan C=O berubah menjadi ikatan C=Nu). E. N I T R I L E.1. Tata nama Senyawa yang mempunyai gugus fungsional –C=N disebut nitril. Alkana yang tak siklik dan sederhana diberi nama dengan menambahkan akhiran pada nama alkananya. Nitril yang lebih kompleks biasanya dianggap sebagai turunan dari asam karboksilat, dan diberi nama dengan mengganti asam -at atau asam -oat diakhiri dengan -onitril, atau dengan mengganti asam -karboksilat diakhiri dengan karbonitril. Perlu dicatat bahwa untuk system yang terakhir, atom karbon nitril tidak diberi nomer. E.2. Pembuatan E.2.1. Reaksi SN2 antara ion sianida dengan alkil halida primer. E.2.2. Dehidrasi amida Dalam reaksi ini tionil klorida sering digunakan, meskipun 'dehydrating agent' yang lain, seperti P2O5, POCl3, atau anhidrida asetat dapat digunakan. Reaksi ini lebih umum dibanding yang pertama, karena tidak dibatasi oleh adanya hambatan sterik dalam alkil halida Dehidrasi ini diawali dengan reaksi pada atom oksigen amida, diikuti oleh reaksi eliminasi. E.3. Reaksi-reaksi nitril Dua reaksi yang paling penting dari nitril adalah bidrolisis dan reduksi. Sebagai tambahan, nitril dapat direduksi dan dihidrolisis secara parsial menghasilkan aldehida, dan dapat direaksikan dengan reagen Grignard menghasilkan keton. E.3.1. Hidrolisis Nitril dihidrolisis baik dalam larutan asam atau basa dalam air untuk menghasilkan asam karboksilat dan ammonia. Mekanisme hidrolisis alkali melibatkan adisi nukleofilik ion hidroksida pada ikatan polar δ+ C=Nδ- dengan cara yang sama dengan adisi nukleofilik pada ikatan karbonil C=O yang polar. Produk awal yang terbentuk adalah hidroksi imina, yang dengan cepat diubah menjadi amida dalam tahap yang mirip dengan konversi enol ke keton. Hidrolisis lebih lanjut dari suatu amida kemudian akan menghasilkan asam karboksilat. Kondisi yang diperlukan untuk hidrolisis alkali nitril adalah keras (KOH, 200°C), dan intermediet amida kadang-kadang dapat diisolasi jika digunakan kondisi yang lebih lunak. E.3.2. Reduksi Nitril bereaksi dengan LiAlH4 menghasilkan amina primer dengan rendemen yang tinggi. Reaksi terjadi melalui adisi nukleofilik ion hidrida pada ikatan C=N yang polar, menghasilkan anion imina. Intermediet ini selanjutnya akan mengadisi ion hidrida kedua menghasilkan amina primer. Meskipun demikian, jika reduktor yang lebih lemah dari pada LiAlH4 digunakan, adisi hidrida kedua tidak terjadi, dan imina dapat dihidrolisis menghasilkan aldehida. Reagen DIBAH berguna untuk reduksi parsial nitril dan merupakan metode yang baik untuk membuat aldehida. E.3.3. Reaksi dengan reagen organologam. Nitril bereaksi dengan reagen Grignard memberikan intermediet anion imina yang dapat dihidrolisis menjadi keton.