1. Pembuatan Logam Natrium ( Na )
advertisement

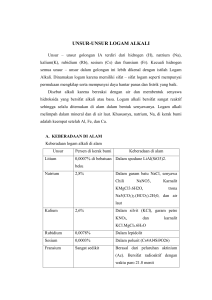
Assalamualaikum Wr. Wb Tema : ALKALI 1. 2. 3. 4. Nama kelompok: Arie Restu Nurhidayani Dita Nur Nur Dwi Wahyuni Isnandita Chandra Pengertian Alkali Alkali berasal dari bahasa arab kali yang berarti abu. Dinamakan alkali karena dapat membentuk basa kuat. Logam atau atom alkali terdapat pada golongan 1A kecuali Hidrogen (H). Unsur logam alkali tidak terdapat bebas di alam melainkan dalam bentuk senyawanya. Logam alkali memiliki titik leleh rendah tetapi senyawa ioniknya mempunyai titik leleh tinggi. Atom Alkali Sifat Periodik 1. Sulit mengalami reduksi dan mudah mengalami oksidasi. 2. Masuk zat pereduksi kuat (memiliki 1 buah elektron pada kulit terluarnya). 3. Keelektronegatifan, energi ionisasi, titik leleh, titik didih dari atas kebawah semakin kecil. 4. Jari-jari dan kerapatannya dari atas kebawah semakin besar. Kecenderungan sifat logam alkali sangat teratur. Dari atas ke bawah secara berurutan semakin besar : • jari-jari atom dan jari-jari ion • massa atom dan massa jenisnya • Keelektropositifan • sifat reduktor Sementara itu, Dari atas ke bawah secara berurutan semakin kecil : energi ionisasi • afinitas elektron • keelektronegatifan • titik leleh • titik didih Titik leleh yang cukup rendah menunjukkan bahwa logam alkali merupakan logam yang lunak. Lunaknya logam bertambah dengan bertambahnya nomor atom. Sifat Fisik dan Kimia 1. Logam alkali berwujud lunak dibanding dengan logam-logam lainnya. 2. Logam alkali titik lebur dan titik didih yang relatif rendah. Dari litium ke sesium titik didihnya semakin rendah. 3. Logam alkali berwarna putih 4. Logam alkali sangat reaktif dan tidak pernah ditemukan dialam dalam bentuk bentuk unsur-unsur yang bebas. 5. Logam alkali merupakan reduktor yang kuat yaitu,logam alkali dapat memberikan sebuah elektron dengan mudah dan bereaksi hebat dengan air untuk membentuk gas hidrogen dan hidroksida-hidroksida atau basa kuat. 6. Energi ionisasi logam alkali relatif rendah. Dari litium ke sesium , energi ionisasinya semakin rendah. Hal ini disebabkan semakin besarnya jari-jari atomnya. 7. Perbedaan energi ionisasi pertama dan energi ionisasi kedua logam alkali sangat besar. Hal ini menunjukkan bahwa dalam senyawanya,logam alkali sangat labil. 8. Logam alkali merupakan unsur-unsur yang ringan. Berdasarkan jenisnya litium,natrium,dan kalium terapung di air. 9. Potensial elektroda logam alkali negatif. Hal ini menunjukkan bahwa logam alkali merupakan reduktor yang kuat. 10. Unsur Li, Na, K sangat ringan 11.Dapat membentuk senyawa basa kuat 12.Sangat reaktif 13.Kelarutannya semakin kebawah semakin besar 14.Bila dipanaskan Li(merah), Na (kuning),K (ungu),Rb (merah),Cs (biru). 15.Bersifat lunak seperti karet penghapus (dapat diiris dengan pisau) Pemanfaatan 1. Kegunaan Natrium ( Na ) • Sebagai pendingin pada reaktor nuklir • Natrium digunakan pada pengolahan logam-logam tertentu • Natrium digunakan pada industri pembuatan bahan anti ketukan pada bensin yaitu TEL (tetraetillead) • Uap natrium digunakan untuk lampu natrium yang dapat menembus kabut • Untuk membuat senyawa natrium seperti Na2O2 (natrium peroksida) dan NaCN (natrium sianida) • Natrium juga digunakan untuk foto sel dalam alat-alat elektronik 2. Kegunaan Senyawa Natrium a. Natrium Klorida Senyawa natrium yang paling banyak diproduksi adalah natrium klorida (NaCl). Natrium klorida dibuat dari air laut/ dari garam batu. Kegunaan senyawa natrium klorida antara lain : • Bahan baku untuk membuat natrium (Na), klorin (Cl2), hydrogen (H2), hydrogen klorida (HCl) serta senyawasenyawa natrium seperti NaOH dan Na2CO3. • Pada industri susu serta pengawetan ikan dan daging. • Di negara yang bermusim dingin, natrium klorida digunakan untuk mencairkan salju di jalan raya. • Regenerasi alat pelunak air. • Pada pengolahan kulit. • Pengolahan bahan makanan yaitu sebagai bumbu masak atau garam dapur. b. Natrium Hidroksida (NaOH) Natrium hidroksida dihasilkan melalui elektrolisis larutan NaCl. Natrium hidroksida disebut dengan nama kaustik soda atau soda api yang banyak digunakan dalam industri berikut : • Industri sabun dan deterjen. Sabun dibuat dengan mereaksikan lemak atau minyak dengan NaOH. • Industri pulp dan kertas. Bahan dasar pembuatan kertas adalah selulosa (pulp) dengan cara memasak kayu, bambu dan jerami dengan kaustik soda (NaOH). • Pada pengolahan aluminium Kaustik soda digunakan untuk mengolah bauksit menjadi Al2O3 (alumina) murni. • NaOH juga digunakan dalam industri tekstil, plastik, pemurnian minyak bumi, serta pembuatan senyawa natrium lainnya seperti NaClO. c. Natrium Karbonat (Na2CO3) Natrium karbonat berasal dari sumber alam yaitu trona dan dapat juga dibuat dari NaCl. Natrium karbonat dinamakan juga soda abu. Natrium karbonat banyak digunakan untuk : • Industri pembuatan kertas, untuk membentuk sabun damar yang berfungsi menolak air dan pengikat serat selulosa (pulp) • Industri kaca, industri deterjen, bahan pelunak air (menghilangkan kesadahan pada air). d. Natrium Bikarbonat (NaHCO3) Natrium bikarbnat disebut juga soda kue. Kegunaannya sebagai bahan pengembang pada pembuatan kue. e. Natrium Sulfida (Na2S) Digunakan bersama-sama dengan NaOH pada proses pengolahan pulp (bahan dasar pembuat kertas). f. Natrium Sulfat (Na2SO4) • Natrium sulfat dibuat dari NaCl dengan H2SO4 dengan pemanasan dengan reaksi : • 2NaCl(s) + H2SO4(l) → Na2SO4(s) + 2HCl(g)\ • kegunaannya sebagai bahan yang dapat dipakai untuk menyimpan energi surya, sehingga dapat dipakai sebagai penghangat ruangan dan penghangat air. • • • • Kegunaan natriun lainnya: NaCN untuk ekstraksi emas dan untuk mengeraskan baja. NaNO2 untuk bahan pengawet. NaHSO3 untuk proses pembuatan pulp. Na2SiO3 untuk bahan perekat atau pengisi dalam industri kertas (karton) dan sebagai bahan pengisi pada industri sabun. Kegunaan Kalium (K) Kegunaan kalium dalam kehidupan sehari-hari adalah sebagai berikut. • Unsur kalium sangat penting bagi pertumbuhan. Tumbuhan membutuhkan garam-garam kalium, tidak sebagai ion K+sendiri, tetapi bersama-sama dengan ion Ca2+ dalam perbandingan tertentu. • Unsur kalium digunakan untuk pembuatan kalium superoksida (KO2) yang dapat bereaksi dengan air membentuk oksigen. Persamaan reaksinya: 4KO2(S) + H2O(l) → 4KOH(aq) + 3O2(g) • senyawa KO2 digunakan sebagai bahan cadangan oksigen dalam tambang (bawah tanah), kapal selam, dan digunakan untuk memulihkan seseorang yang keracunan gas. Kegunaan Senyawa kalium Kegunaan senyawa kalium ialah sebagai berikut : • KOH digunakan pada industri sabun lunak atau lembek. • KCl dan K2SO4 digunakan untuk pupuk pada tanaman. • KNO3 digunakan sebagai komponen esensial dari bahan peledak, petasan dan kembang api. • KClO3 digunakan untuk pembuatan korek api, bahan peledak, dan mercon. KClO3 dapat juga digunakan sebagai bahan pembuat gas Cl2, apabila direaksikan dengan larutan HCl pada laboratorium. • K2CO3 digunakan pada industri kaca. Selain natrium dan kalium, kegunaan logam alkali sebagai berikut : • Litium digunakan untuk membuat baterai. • Rubidium (Rb) dan Cesium (Cs) digunakan sebagai permukaan peka cahaya dalam sel fotolistrik yang dapat mengubah cahaya menjadi listrik. • Li2CO3 digunakan untuk pembuatan beberapa jenis peralatan gelas dan keramik. Pembuatan logam alkali den senyawanya. 1. Pembuatan Logam Natrium ( Na ) Logam natrium dibuat dengan cara elektrolisis leburan (lelehan) NaCl yang dicampur CaCl2 yang berguna untuk menurunkan titik leleh/cair dari 800 C menjadi sekitar 500 C. Karena potensial reduksi ion Ca2+ lebih negatif dari potensial reduksi ion Na+ maka pada elektrolisis hanya terjadi reduksi ion Na+. Alat yang digunakan pada pembuatan logan Na ini disebut sel Down. • • • • 2. Pembuatan Logam Kalium ( K ) elektrolisis lelehan KOH elektrolisis lelehan KCN reduksi garam kloridanya reduksi KCl dengan natrium 3. Pembuatan Logam Litium ( Li ) • Litium ( Li) dibuat secara elektrolisis cairan LiCl, logam Li diperoleh di katoda dan gas Cl2 diperoleh di anoda 4. Pembuatan Senyawa Natrium Hidroksida (NaOH ) • Senyawa natrium hidroksida dapat dibuat dengan cara elektrolisis larutan NaCl. Alat yang digunakan disebut Sel Nelson